

分析 含有鋁、鐵、銅的合金加入氫氧化鈉溶解,只有鋁與氫氧化鈉反應生成偏鋁酸鈉和氫氣,所以濾渣B為鐵和銅,再經稀硫酸反應過濾的濾液為氯化亞鐵,進一步轉化成綠礬,濾渣F為銅單質,進一步轉化成膽礬;濾液A則為偏鋁酸鈉溶液,加過量鹽酸經途徑Ⅰ生成氯化鋁溶液,而濾液A通足量氣體C經途徑Ⅱ生成沉淀D,根據氫氧化鋁只溶于強酸強堿,所以氣體C為二氧化碳,沉淀D為氫氧化鋁,與鹽酸反應生成氯化鋁溶液,
(1)鋁離子水解生成氫氧化鋁和氫離子,溶液顯示酸性,氫氧化鋁受熱分解生成氧化鋁和水.
(2)A→C的反應就是偏鋁酸鈉溶液中通入過量的二氧化碳的反應;
(3)濾液D為氯化亞鐵溶液,檢驗Fe2+的試劑是KSCN溶液和新制氯水;
(4)濾渣F為銅單質,轉化成膽礬的方法是在濾渣F中加入硫酸再通入熱空氣反應成CuSO4溶液;
(5)廢料中有Al,Al為兩性元素;
(6)濾液D為氯化亞鐵溶液,加入雙氧水將把Fe2+氧化為Fe3+;
(7)用CuSO4溶液作粗銅的精煉液,陰極上發生的電極反應式為還原反應;
(8)鈉是活潑金屬,工業上生產鈉是用電解熔融的NaCl可得Na.
解答 解:(1)氯化鋁溶液中,鋁離子水解生成氫氧化鋁和氫離子,導致溶液顯示酸性,實質是:Al3++3H2O?Al(OH)3+3H+,把AlCl3溶液蒸干灼燒,水解平衡向右移動,生成氫氧化鋁,同時鹽酸揮發,最后得到的主要固體產物是氫氧化鋁,受熱分解生成氧化鋁和水,
故答案為:Al2O3;
(2)偏鋁酸鈉溶液中通入過量的二氧化碳的反應:NaAlO2+CO2+2H2O=Al(OH)3↓+NaHCO3;
故答案為:NaAlO2+CO2+2H2O=Al (OH)3↓+NaHCO3;
(3)濾液D為氯化亞鐵溶液,檢驗Fe2+的方法是:取少量D溶液于試管中,滴加KSCN溶液,無現象,再滴加新制氯水,溶液變成血紅色,有Fe 2+存在.
故答案為:取少量D溶液于試管中,滴加KSCN溶液,無現象,再滴加新制氯水,溶液變成血紅色,有Fe 2+存在;
(4)濾渣F為銅單質,轉化成膽礬的方法是在濾渣F中加入硫酸再通入熱空氣反應成CuSO4溶液,化學方程式為2Cu+2 H2SO4+O2=2CuSO4+2 H2O;
故答案為:2Cu+2 H2SO4+O2=2CuSO4+2 H2O;
(5)廢料中有Al,Al為兩性元素,Al溶于NaOH溶液的離子方程式為2Al+2OH-+2H2O=2AlO2-+3H2↑,
故答案為:2Al+2OH-+2H2O=2AlO2-+3H2↑;
(6)濾液D為氯化亞鐵溶液,加入雙氧水將把Fe2+氧化為Fe3+,故溶液由淺綠色變為黃色,
故答案為:溶液變為黃色;
(7)用CuSO4溶液作粗銅的精煉液,陰極上發生的電極反應式為還原反應,Cu2++2e-=Cu,
故答案為:Cu2++2e-=Cu;
(8)工業上生產鈉是用電解熔融的NaCl可得Na:2NaCl$\frac{\underline{\;通電\;}}{\;}$2Na+Cl2↑,
故答案為:2NaCl$\frac{\underline{\;通電\;}}{\;}$2Na+Cl2↑.
點評 本題主要考查了從工業廢料中制取純凈物,注意從框圖轉化中找出有用信息,利用有關的化學反應進行解答,難度中等.


科目:高中化學 來源: 題型:解答題
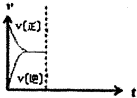 已知三個反應如下:
已知三個反應如下:| T/℃ | 700℃ | 800℃ |
| K1 | 2.38 | 2.56 |
| K2 | 0.80 |
| 反應時間/min | 0 | 2 | 4 | 6 |
| N(CO)/mol | 1.20 | 0.90 | 0.80 | |
| N(H2O)/mol | 0.60 | 0.20 |
查看答案和解析>>
科目:高中化學 來源: 題型:實驗題
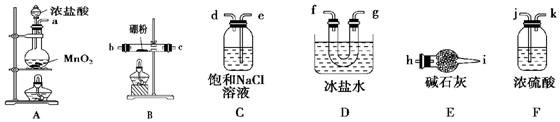
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| A. | 0.15 mol | B. | 0.3 mol | C. | 0.45 mol | D. | 0.6mol |
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| A. | 400mL | B. | 500mL | C. | 450mL | D. | 無法確定 |
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| A. | 酸性氧化物 干冰 CO2 | B. | 堿 純堿 Na2CO3 | ||
| C. | 酸 硫酸 H2SO3 | D. | 單質 氯水 Cl2 |
查看答案和解析>>
科目:高中化學 來源: 題型:填空題
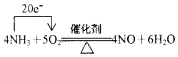 .若有標準狀況下V L氨氣完全反應,并轉移n個電子,則阿伏加德羅常數(NA)可表示為$\frac{22.4n}{5V}$(寫出含字母的表達式).
.若有標準狀況下V L氨氣完全反應,并轉移n個電子,則阿伏加德羅常數(NA)可表示為$\frac{22.4n}{5V}$(寫出含字母的表達式).查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| 選項 | A | B | C | D |
| 第一次加入 | Al | Na | Zn | Mg |
| 第二次加入 | K | Mg | Al | Cu |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
科目:高中化學 來源: 題型:實驗題
| 化學式 | 顏色 | Ksp |
| AgCl | 白色 | 2.0×10-10 |
| AgBr | 淺黃色 | 5.4×10-13 |
| AgI | 黃色 | 8.3×10-17 |
| Ag2S | 黑色 | 2.0×10-48 |
| Ag2CrO4 | 紅色 | 2.0×10-12 |
查看答案和解析>>
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com