
【題目】下列溶液混合后,不會發生離子反應的是( )
A.硝酸鋇溶液和硫酸鈉溶液B.醋酸鈉溶液和稀硫酸
C.碳酸鉀溶液和稀鹽酸溶液D.硝酸鉀溶液和氯化銅溶液
 華東師大版一課一練系列答案
華東師大版一課一練系列答案科目:高中化學 來源: 題型:
【題目】稠環芳香烴是指兩個或兩個以上的苯環通過共用環邊所構成的多環有機化合物。常見的稠環芳香烴如萘、蒽、菲、芘等,其結構分別為
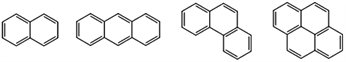
萘 蒽 菲 芘
下列說法不正確的是
A. 萘的分子式為C10H8,與H2完全加成后,產物的分子式為C10H18
B. 蒽、菲、芘的一氯代物分別有3種、5種、5種
C. 上述四種物質的分子中,所有碳原子均共平面
D. 上述四種物質均可與濃硝酸發生硝化反應
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】保險粉又稱連二亞硫酸鈉(Na2S2O4),可用于紡織工業的漂白劑、脫色劑,脫氯劑。Na2S2O4是白色粉末,無味,易溶于水、難溶于乙醇,具有極強的還原性,在空氣中易被氧化,在堿性介質中穩定。
Ⅰ.甲酸鈉(HCOONa)法制備過程如下:

(1)連二亞硫酸鈉中硫元素的化合價為______________。
(2)實驗室用Na2SO3 固體和某酸反應制備SO2氣體,制備SO2時所選用的酸,你認為下列最適宜選用的是______________。
A.濃鹽酸 B.濃硝酸
C.質量分數為70%的硫酸 D.質量分數為10%的硫酸
(3)步驟①中制備連二亞硫酸鈉的化學方程式可表示為____________________________。
(4)上述步驟②中,加入適量乙醇水溶液的作用是______________。
(5)在包裝保存“保險粉”時加入少量的Na2CO3固體,目的是_________________________。
(6)①現將0.05mol/L Na2S2O4溶液在空氣中放置,其溶液的pH 與時間(t)的關系如圖所示。

t1時溶液中只有NaHSO3一種溶質,此時含硫元素的粒子濃度由大到小的順序為_______________。
②t1~t2段發生化學反應的離子方程式為______________________________。
Ⅱ.電解法制備:工業上用惰性電極電解NaHSO3溶液得到Na2S2O4。過程如圖所示

(7)①產品在_________________(填“陽極”、“陰極”)得到。
②若不加隔膜,則連二亞硫酸鈉產率降低,其原因是__________________________________。
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】Mg—H2O2電池可用于驅動無人駕駛的潛航器。該電池以海水為電解質溶液,示意圖如下。該電池工作時,下列說法正確的是

A. 鎂電極是該電池的正極
B. 過氧化氫在石墨電極上發生氧化反應
C. 石墨電極附近溶液的pH增大
D. 溶液中氯離子向正極移動
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】某小組同學利用下列實驗探究金屬鋁與不同銅鹽溶液的反應:
實驗 | 實驗方案 | 現象 |
1 | 向5mLlmol/LCuSO4溶液中加入用砂紙打磨過的鋁片 | 鋁片表面無明顯現象,20min后鋁片表面有極少氣泡,且有很少量紅色物質生成 |
2 | 向5mLlmol/LCuCl2溶液中加入用砂紙打磨過的鋁片 | 鋁片表面有氣泡產生,同時有紅色物質析出,1min后反應進一步加快,放出大量的熱,有少量黑色固體生成。一段時間后燒杯底部出現白色沉淀 |
(1)打磨鋁片的目的是_____________________________。
(2)實驗中出現的紅色物質是_______________________________。
(3)實驗2中“1min后反應進一步加快”的原因是________________________________。
(4)經檢驗實驗1、2中產生的無色氣體是H2,黑色固體為CuO,試用離子方程式解釋H2產生的原因__________________________,用文字簡述黑色固體產生的原因____________________________。
(5)依據上述實驗1、2現象推測并判斷,用砂紙打磨后的鋁片分別與H+濃度均為0.2molL-1的鹽酸和硫酸反應,反應速率:前者比后者____________(填“快”或“慢”)
(6)經證明實驗2 中白色沉淀的化學成分為CuCl。某同學猜測可能是Cu與CuCl2溶液反應生成了CuCl,因為Cu具有________性。依據猜測他進行了如下實驗:取Cu粉與適量1mol/LCuCl2溶液混合,一段時間后觀察無白色沉淀產生。該同學再次分析Al 與CuCl2溶液反應的實驗現象,改進實驗方案,證明了Cu與CuCl2溶液反應生成了CuCl,他的改進方法為__________________。
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】工業上用鋁土礦(主要成份是Al2O3,還含有Fe2O3、SiO2)提取氧化鋁冶煉鋁的原料(純凈的Al2O3),提取操作過程如下:

請回答下列問題:
(1)請寫主要成份的化學式:濾渣A________,濾液丙中的溶質是NaCl和________。
(2)反應②中Al3+反應的離子方程式為_________________;反應③的離子方程式為____________;反應④的化學方程式為______________________________。
查看答案和解析>>
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com