
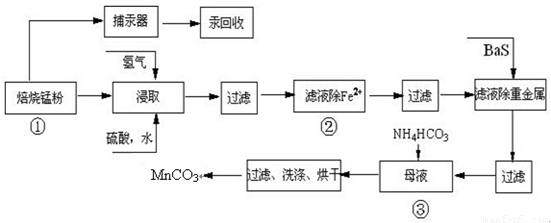
| 實驗操作 | 離子方程式 |
| 步驟1:取少量濾液于試管中,加入過量酸化的H2O2溶液,振蕩. | ______ |
| 步驟2:將pH調到______,使Fe3+沉淀完全 | Fe3++3H2O?Fe(OH)3+3H+ |


科目:高中化學 來源: 題型:
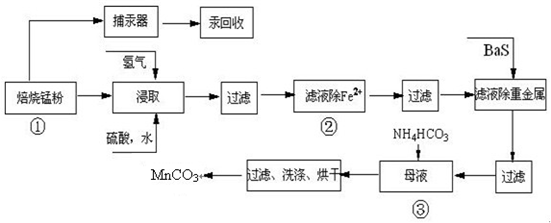
| 實驗操作 | 離子方程式 |
| 步驟1:取少量濾液于試管中,加入過量酸化的H2O2溶液,振蕩. | 2Fe2++H2O2+2H+=2Fe3++2H2O 2Fe2++H2O2+2H+=2Fe3++2H2O |
| 步驟2:將pH調到 3.7~8.6 3.7~8.6 ,使Fe3+沉淀完全 |
Fe3++3H2O?Fe(OH)3+3H+ |
查看答案和解析>>
科目:高中化學 來源: 題型:閱讀理解

| 實驗目的 | 操作 | 實驗現象 | 結論 |
| 1.檢驗Cl- | 取少許濾液于試管中, 加入硝酸酸化的硝酸銀溶液 加入硝酸酸化的硝酸銀溶液 |
有白色沉淀產生 有白色沉淀產生 |
含有Cl- |
| 2.檢驗NH4+ | 取少許濾液于試管中, 加入濃氫氧化鈉溶液并加熱,將潤濕的紅色石蕊試紙置于試管口附近 加入濃氫氧化鈉溶液并加熱,將潤濕的紅色石蕊試紙置于試管口附近 |
石蕊試紙變藍色 石蕊試紙變藍色 |
含有NH4+ |
| 3.檢驗Zn2+ | 取少許濾液于試管中,加入稀氨水 | 先產生白色沉淀,繼續加入氨水,沉淀又溶解 | 含有Zn2+ |
查看答案和解析>>
科目:高中化學 來源: 題型:解答題
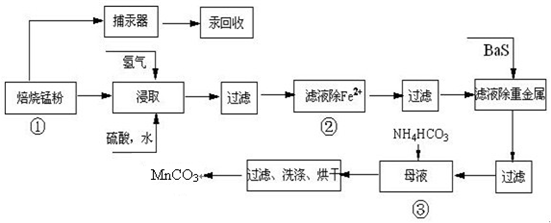
| 實驗操作 | 離子方程式 |
| 步驟1:取少量濾液于試管中,加入過量酸化的H2O2溶液,振蕩. | ______ |
| 步驟2:將pH調到______,使Fe3+沉淀完全 | Fe3++3H2O?Fe(OH)3+3H+ |
查看答案和解析>>
科目:高中化學 來源:梅州一模 題型:問答題
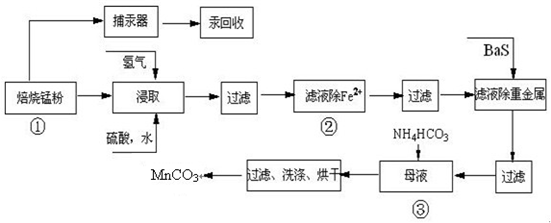
| 實驗操作 | 離子方程式 |
| 步驟1:取少量濾液于試管中,加入過量酸化的H2O2溶液,振蕩. | ______ |
| 步驟2:將pH調到______,使Fe3+沉淀完全 | Fe3++3H2O?Fe(OH)3+3H+ |
查看答案和解析>>
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com