
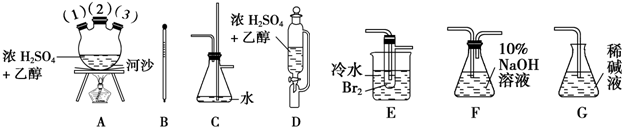
分析 以乙醇、濃硫酸和溴為原料制備1,2二溴乙烷.已知1,2二溴乙烷熔點為9℃,C2H5OH$→_{濃硫酸}^{170℃}$CH2=CH2↑+H2O,第一:必須除去混在乙烯中的氣體雜質,尤其是SO2氣體,以防止SO2與Br2發生反應SO2+Br2+2H2O=2HBr+H2SO4,影響1,2-二溴乙烷產品的制備;第二:必須在理解的基礎上靈活組裝題給的不太熟悉的實驗儀器(如三頸燒瓶A、恒壓滴液漏斗D、安全瓶防堵塞裝置C),反應管E中冷水的作用是盡量減少溴的揮發,儀器組裝順序是:制取乙烯氣體(用A、B、D組裝)一安全瓶(C,兼防堵塞)→凈化氣體(F,用NaOH溶液吸收CO2和SO2等酸性雜質氣體)→制備1,2-二溴乙烷的主要反應裝置(E)→尾氣處理(G)”,
(1)儀器組裝順序是:制取乙烯氣體(用A、B、D組裝)一安全瓶(C,兼防堵塞)→凈化氣體(F,用NaOH溶液吸收CO2和SO2等酸性雜質氣體)→制備1,2-二溴乙烷的主要反應裝置(E)→尾氣處理(G)”;
(2)儀器D的漏斗為恒壓滴液漏斗,可以恒壓分液,混合溶液加熱需要防止暴沸;
(3)儀器C的兩個作用是防止倒吸、避免裝置內壓強增大,氣體通道被阻塞而發生危險;
(4)溫度計的位置應位于三頸瓶的液體中央,插入溶液液面以下,但不能接觸瓶底;
(5)溴易揮發,把反應管E置于盛有冷水的小燒杯中,可降低溫度,減少揮發;
(6)若產物中有少量未反應的Br2,1,2二溴乙烷在氫氧化鈉溶液中會水解,飽和亞硫酸氫鈉溶液具有還原性可以和溴單質發生反應,碘化鈉溶液和溴單質反應生成的碘單質,會溶解到生成的鹵代烴;乙醇也會溶解1,2二溴乙烷;
(7)溫度在140°C會發生反應生成乙醚,利用1,2-二溴乙烷與乙醚的沸點不同進行解答;
解答 解:(1)儀器組裝順序為:制取乙烯氣體(用A、B、D組裝)→安全瓶(C,兼防堵塞)→凈化氣體(F,用NaOH溶液吸收CO2和SO2等酸性雜質氣體)→制備1,2-二溴乙烷的主要反應裝置(E)→尾氣處理(G),
故答案為:C;F;E;G;
(2)裝置D為恒壓滴液漏斗,該反應溫度較高,容器內壓強較大,若容器內壓力過大時液體無法滴落,選用恒壓滴液漏斗,可以平衡上下壓強,使液體順利滴下,河沙作用是防止溶液加熱暴沸,
故答案為:平衡上下壓強,使液體順利滴下;防止暴沸;
(3)裝置C為安全瓶,起到防止倒吸的作用,同時防止氣體通道被阻塞而發生危險,
故答案為:安全瓶防止倒吸;防止氣體通道被阻塞而發生危險;
(4)乙醇在濃硫酸作用下加熱到1700C時發消去反應生成乙烯,則溫度計的位置應位于三頸瓶的液體中央,插入溶液液面以下,但不能接觸瓶底,
故答案為:溫度計插入液面以下;位于三頸瓶的液體中央;不接觸瓶底;
(5)溴易揮發,為減少揮發,在反應管E中加入少量水可起到水封的作用,把反應管E置于盛有冷水的小燒杯中,可降低溫度,減少揮發,
故答案為:溴易揮發,可以減少溴的揮發;
(6)若產物中有少量未反應的Br2,
a.飽和亞硫酸氫鈉溶液和溴單質發生氧化還原反應,可以除去溴單質,故a正確;
b.氫氧化鈉溶液中溴單質發生反應,1,2二溴乙烷也會發生水解,不能除雜,故b錯誤;
c.碘化鈉溶液和溴單質發生氧化還原反應生成碘單質也會溶于鹵代烴,不能除雜,故c錯誤;
d.乙醇能溶解溴單質和鹵代烴,不能除雜,故d錯誤;
故答案為:a;
(7)溫度在140°C會發生反應生成乙醚,溫度在170°C生成乙烯,產品中可能會有的有機雜質,分離混合物是利用1,2-二溴乙烷與乙醚的沸點不同,通過蒸餾方法分離,
故答案為:乙醚;蒸餾;
點評 本題考查有機物制備及性質實驗方案的設計,題目難度中等,解答本題的關鍵是把握制備實驗的原理,能正確設計實驗順序,牢固把握實驗基本操作時解答該類題目的保證,學習中注意加強相關知識的全面把握.


 每課必練系列答案
每課必練系列答案科目:高中化學 來源: 題型:選擇題
| A. | 密度之比為7:11 | B. | 體積之比為11:7 | ||
| C. | 物質的量之比為7:11 | D. | 質量之比為11:7 |
查看答案和解析>>
科目:高中化學 來源: 題型:填空題
查看答案和解析>>
科目:高中化學 來源: 題型:解答題
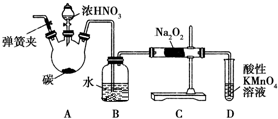 亞硝酸鈉(NaNO2)被稱為工業鹽,在漂白、電鍍等方面應用廣泛.以木炭、濃硝酸、水和銅為原料制備亞硝酸鈉的裝置如圖所示.已知:室溫下,①2NO+Na2O2═2NaNO2;②3NaNO2+3HCl═3NaCl+HNO3+2NO↑+H2O;③酸性條件下,NO或NO2-都能與MnO4-反應生成NO3-和Mn2+.
亞硝酸鈉(NaNO2)被稱為工業鹽,在漂白、電鍍等方面應用廣泛.以木炭、濃硝酸、水和銅為原料制備亞硝酸鈉的裝置如圖所示.已知:室溫下,①2NO+Na2O2═2NaNO2;②3NaNO2+3HCl═3NaCl+HNO3+2NO↑+H2O;③酸性條件下,NO或NO2-都能與MnO4-反應生成NO3-和Mn2+.查看答案和解析>>
科目:高中化學 來源: 題型:解答題
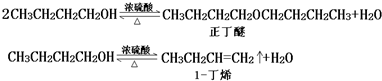
| 化合物 | 密度(g•cm-3) | 水溶性 | 沸點(℃) |
| 冰乙酸 | 1.05 | 易溶 | 118.1 |
| 正丁醇 | 0.80 | 微溶 | 117.2 |
| 正丁醚 | 0.77 | 不溶 | 142.0 |
| 乙酸正丁酯 | 0.90 | 微溶 | 126.5 |

查看答案和解析>>
科目:高中化學 來源: 題型:解答題

查看答案和解析>>
科目:高中化學 來源: 題型:解答題
查看答案和解析>>
科目:高中化學 來源: 題型:實驗題
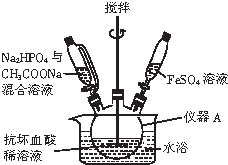 磷酸亞鐵晶體[Fe3(PO4)2•8H2O]是藍白色單斜晶體,溶于稀強酸,不溶于水、醋酸、醇,主要用于制作磷酸鐵銼電池.實驗室制備磷酸亞鐵晶體的裝置、反應原理和實驗步驟如下:
磷酸亞鐵晶體[Fe3(PO4)2•8H2O]是藍白色單斜晶體,溶于稀強酸,不溶于水、醋酸、醇,主要用于制作磷酸鐵銼電池.實驗室制備磷酸亞鐵晶體的裝置、反應原理和實驗步驟如下:查看答案和解析>>
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com