
納米級Cu2O由于具有優(yōu)良的催化性能而受到關注,下表為制取Cu2O的三種方法:
|
方法Ⅰ |
用炭粉在高溫條件下還原CuO |
|
方法Ⅱ |
電解法,反應為2Cu +
H2O |
|
方法Ⅲ |
用肼(N2H4)還原新制Cu(OH)2 |
(1)工業(yè)上常用方法Ⅱ和方法Ⅲ制取Cu2O而很少用方法Ⅰ,其原因是 。
(2)已知:2Cu(s)+1/2O2(g)=Cu2O(s) △H = -akJ·mol-1
C(s)+1/2O2(g)=CO(g) △H = -bkJ·mol-1
Cu(s)+1/2O2(g)=CuO(s) △H = -ckJ·mol-1
則方法Ⅰ發(fā)生的反應:2CuO(s)+C(s)= Cu2O(s)+CO(g);△H = kJ·mol-1。
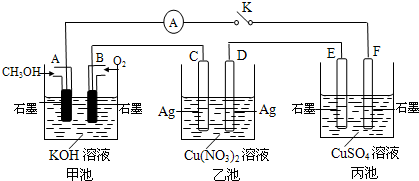
(3)方法Ⅱ采用離子交換膜控制電解液中OH-的濃度而制備納米Cu2O,裝置如圖所示,該電池的陽極反應式為 。

(4)方法Ⅲ為加熱條件下用液態(tài)肼(N2H4)還原新制Cu(OH)2來制備納米級Cu2O,同時放出N2。該制法的化學方程式為 。
(5)在相同的密閉容器中,用以上兩種方法制得的Cu2O分別進行催化分解水的實驗:
 △H
>0
△H
>0
水蒸氣的濃度隨時間t變化如下表所示。
|
序號 |
|
0 |
10 |
20 |
30 |
40 |
50 |
|
① |
T1 |
0.050 |
0.0492 |
0.0486 |
0.0482 |
0.0480 |
0.0480 |
|
② |
T1 |
0.050 |
0.0488 |
0.0484 |
0.0480 |
0.0480 |
0.0480 |
|
③ |
T2 |
0.10 |
0.094 |
0.090 |
0.090 |
0.090 |
0.090 |
下列敘述正確的是 (填字母代號)。
A.實驗的溫度:T2<T1
B.實驗①前20 min的平均反應速率 v(O2)=7×10-5 mol·L-1 min-1
C.實驗②比實驗①所用的催化劑催化效率高
(1)由于在高溫下,碳有可能把氧化銅還原生成銅,即不易控制反應條件。(2分)
(2)-(a+b-2c)kJ/mol。或2c –a-b(2分) (3)2Cu-2e-+2OH-=Cu2O+H2O。(2分)
(4)4Cu(OH)2 + N2H4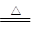 2Cu2O + N2↑ + 6H2O。(2分) (5)C(1分)
2Cu2O + N2↑ + 6H2O。(2分) (5)C(1分)
【解析】
試題分析:(1)由于在高溫下,碳有可能把氧化銅還原生成銅,不易控制反應條件,所以一般不用方法I。
(2)根據(jù)蓋斯定律可知,①+②-③×2即得到反應2CuO(s)+C(s)= Cu2O(s)+CO(g),所以該反應的反應熱△H =-akJ/mol-bkJ/mol+2ckJ/mol=-(a+b-2c)kJ/mol。
(3)銅電極和電源的正極相連,做陽極,失去電子,則電極反應式是2Cu-2e-+2OH-=Cu2O+H2O。
(4)根據(jù)原子守恒可知,生成物還有水生成,所以反應的化學方程式是4Cu(OH)2 + N2H4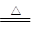 2Cu2O + N2↑ + 6H2O。
2Cu2O + N2↑ + 6H2O。
(5)該反應是吸熱反應反應,則升高溫度平衡向正反應方向移動,所以水蒸氣的轉(zhuǎn)化率高,則根據(jù)表中數(shù)據(jù)可知,溫度應該是T2>T1,A不正確;實驗①前20 min的平均反應速率 v(O2)=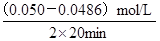 =3.5×10-5 mol·L-1
min-1,B不正確;實驗②比實驗①達到平衡所用的時間少,說明反應速率快,使用的催化劑催化效率高,C正確,答案選C。
=3.5×10-5 mol·L-1
min-1,B不正確;實驗②比實驗①達到平衡所用的時間少,說明反應速率快,使用的催化劑催化效率高,C正確,答案選C。
考點:考查反應反應熱、反應速率的計算、電極反應式和化學方程式的書寫以及外界條件對反應速率和平衡狀態(tài)的影響
點評:該題是高考中的常見考點和題型,屬于中等難度試題的考查,試題綜合性強,側(cè)重對學生能力的培養(yǎng)和解題方法的指導與訓練,旨在考查學生靈活運用基礎知識解決實際問題的能力,有利于培養(yǎng)學生的邏輯推理能力和發(fā)散思維能力,提升學生的學科素養(yǎng)。


科目:高中化學 來源: 題型:
| 1 |
| 2 |
| 1 |
| 2 |
| ||
| ||
查看答案和解析>>
科目:高中化學 來源:2011屆江蘇省淮安市高三第四次調(diào)研測試化學試卷 題型:填空題
(10分)納米級Cu2O由于具有優(yōu)良的催化性能而受到關注,下表為制取Cu2O的三種方法:
| 方法Ⅰ | 用炭粉在高溫條件下還原CuO |
| 方法Ⅱ | 電解法,反應為2Cu + H2O  Cu2O + H2↑。 Cu2O + H2↑。 |
| 方法Ⅲ | 用肼(N2H4)還原新制Cu(OH)2 |

 出N2。該制法的化學方程式為 ▲ 。
出N2。該制法的化學方程式為 ▲ 。 △H>0,水蒸氣的濃度隨時間t變化如下表所示。
△H>0,水蒸氣的濃度隨時間t變化如下表所示。
查看答案和解析>>
科目:高中化學 來源:2011-2012學年山西省高三高考模擬(四)理綜化學試卷(解析版) 題型:填空題
(13分)納米級Cu2O由于具有優(yōu)良的催化性能而受到關注,下表為制取Cu2O的三種方法:
|
方法Ⅰ |
用炭粉在高溫條件下還原CuO |
|
方法Ⅱ |
電解法,反應為2Cu
+ H2O |
|
方法Ⅲ |
用肼(N2H4)還原新制Cu(OH)2 |
(1)工業(yè)上常用方法Ⅱ和方法Ⅲ制取Cu2O而很少用方法Ⅰ,其原因是 。
(2)已知:2Cu(s)+1/2O2(g)=Cu2O(s) △H = -akJ·mol-1
C(s)+1/2O2(g)=CO(g) △H = -bkJ·mol-1
Cu(s)+1/2O2(g)=CuO(s) △H = -ckJ·mol-1
則方法Ⅰ發(fā)生的反應:2CuO(s)+C(s)= Cu2O(s)+CO(g);△H = kJ·mol-1。
(3)方法Ⅱ采用離子交換膜控制電解液中OH-的濃度而制備納米Cu2O,裝置如圖所示,該電池的陽極反應式為 。

(4)方法Ⅲ為加熱條件下用液態(tài)肼(N2H4)還原新制Cu(OH)2來制備納米級Cu2O,同時放出N2。該制法的化學方程式為 。
(5)在相同的密閉容器中,用以上兩種方法制得的Cu2O分別進行催化分解水的實驗: △H >0
△H >0
水蒸氣的濃度隨時間t變化如下表所示。
|
序號 |
|
0 |
10 |
20 |
30 |
40 |
50 |
|
① |
T1 |
0.050 |
0.0492 |
0.0486 |
0.0482 |
0.0480 |
0.0480 |
|
② |
T1 |
0.050 |
0.0488 |
0.0484 |
0.0480 |
0.0480 |
0.0480 |
|
③ |
T2 |
0.10 |
0.094 |
0.090 |
0.090 |
0.090 |
0.090 |
下列敘述正確的是 (填字母代號)。
A.實驗的溫度:T2<T1
B.實驗①前20 min的平均反應速率 v(O2)=7×10-5 mol·L-1 min-1
C.實驗②比實驗①所用的催化劑催化效率高
查看答案和解析>>
科目:高中化學 來源:2010-2011學年江蘇省淮安市高三第四次調(diào)研測試化學試卷 題型:填空題
(10分)納米級Cu2O由于具有優(yōu)良的催化性能而受到關注,下表為制取Cu2O的三種方法:
|
方法Ⅰ |
用炭粉在高溫條件下還原CuO |
|
方法Ⅱ |
電解法,反應為2Cu + H2O |
|
方法Ⅲ |
用肼(N2H4)還原新制Cu(OH)2 |
(1)工業(yè)上常用方法Ⅱ和方法Ⅲ制取Cu2O而很少用方法Ⅰ,其原因是 ▲ 。
(2)已知:2Cu(s)+1/2O2(g)=Cu2O(s) △H = -169kJ·mol-1
C(s)+1/2O2(g)=CO(g) △H = -110.5kJ·mol-1
Cu(s)+1/2O2(g)=CuO(s) △H = -157kJ·mol-1
則方法Ⅰ發(fā)生的反應:2CuO(s)+C(s)= Cu2O(s)+CO(g);△H = ▲ kJ·mol-1。
(3)方法Ⅱ采用離子交換膜控制電解液中OH-的濃度而制備納米Cu2O,裝置如圖所示,該電池的陽極反應式為 ▲ 。

(4)方法Ⅲ為加熱條件下用液態(tài)肼(N2H4)還原新制Cu(OH)2來制備納米級Cu2O,同時放出N2。該制法的化學方程式為 ▲ 。
(5)在相同的密閉容器中,用以上兩種方法制得的Cu2O分別進行催化分解水的實驗: △H>0,水蒸氣的濃度隨時間t變化如下表所示。
△H>0,水蒸氣的濃度隨時間t變化如下表所示。

下列敘述正確的是 ▲ (填字母代號)。
A.實驗的溫度:T2<T1
B.實驗①前20 min的平均反應速率 v(H2)=7×10-5 mol·L-1 min—1
C.實驗②比實驗①所用的催化劑催化效率高
查看答案和解析>>
湖北省互聯(lián)網(wǎng)違法和不良信息舉報平臺 | 網(wǎng)上有害信息舉報專區(qū) | 電信詐騙舉報專區(qū) | 涉歷史虛無主義有害信息舉報專區(qū) | 涉企侵權(quán)舉報專區(qū)
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com