
【題目】反應4A(s)+3B(g) ![]() 2C(g)+D(g),經2 min B的濃度減少0.6 mol·L-1。對此反應速率的正確表示是
2C(g)+D(g),經2 min B的濃度減少0.6 mol·L-1。對此反應速率的正確表示是
A. 用A表示的反應速率是0.8 mol·L-1·s-1
B. 分別用B、C、D表示反應的速率,其比值是3∶1∶2
C. 在2 min末時的反應速率,用產物C來表示是0.2mol·L-1·min-1
D. 在這2 min內用B和C表示的反應速率的值都是不同的
 閱讀快車系列答案
閱讀快車系列答案科目:高中化學 來源: 題型:
【題目】某學習小組對SO2使溶液褪色的機理進行探究。
I.SO2氣體的制備和性質初探
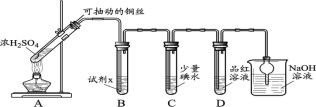
(1)裝置A中發生反應的化學方程式____________。
(2)裝置B中的試劑x是____________。
(3)小組同學觀察到C、D中溶液均褪色,通過檢驗C溶液中有SO42-,得出C中溶液褪色的原因是____________。
II.小組同學通過實驗繼續對D中品紅溶液褪色進行探究。
(4)探究使品紅褪色的主要主要微粒(分別取2 mL試劑a,滴加2滴品紅溶液)
裝置 | 序號 | 試劑a | 實驗現象 |
| i | 0.1 mol/L SO2溶液(pH=2) | 紅色逐漸變淺,之后完全褪色 |
ii | 0.1 mol/L NaHSO3溶液(pH=5 ) | 紅色立即變淺,之后完全褪色 | |
iii | 0.1 mol/L Na2SO3溶液( pH=10) | 紅色立即褪色 | |
iv | pH=2H2SO4溶液 | 紅色無明顯變化 | |
v | 試劑a | 紅色無明顯變化 |
①實驗 iii中Na2SO3溶液顯堿性的原因_____________(結合化學用語分析解釋)。
②對比實驗iii 和v,可以排除在該實驗條件下OH-對品紅褪色的影響,則試劑a可能
是__________溶液。
查閱資料:品紅與SO2水溶液、NaHSO3溶液、Na2SO3溶液反應前后物質如下:
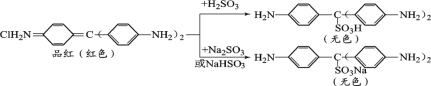
③通過上述實驗探究并結合資料,小組同學得出結論:一是使品紅溶液褪色的主要微粒是________;二是品紅溶液中顏色變化主要與其分子中的________結構有關。
(5)驗證SO2使品紅褪色反應的可逆性
①甲同學加熱實驗i褪色后的溶液,產生刺激性氣味氣體,紅色恢復,從化學平衡移動角度解釋紅色恢復的原因__________。
②乙同學向實驗i褪色后的溶液中滴入Ba(OH)2溶液至pH=10,生成白色沉淀,溶液變紅。寫出生成白色沉淀的離子方程式___________。
③丙同學利用SO2的還原性,運用本題所用試劑,設計了如下實驗,證實了SO2使品紅褪色反應的可逆:則試劑Y是__________。

查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】二甲醚是一種重要的清潔燃料。合成二甲醚是解決能源危機的研究方向之一。
(1)用CO2和H2可以合成二甲醚(CH3OCH3)。
已知:CO(g)+2H2(g)=CH3OH(g) ΔH1=-90.1 kJ·mol-1
CO(g)+H2O(g)=CO2(g)+H2(g) ΔH2=-41.1 kJ·mol-1
2CH3OH(g)=CH3OCH3(g)+H2O(g) ΔH3=-24.5 kJ·mol-1
則反應2CO2(g)+6H2(g)=CH3OCH3(g)+3H2O(g)ΔH=________。
(2)二甲醚(CH3OCH3)燃料電池可以提升能量利用率。利用二甲醚酸性介質燃料電池電解200 mL飽和食鹽水(惰性電極),一段時間后,陰極收集到標況下的氫氣2.24 L(設電解后溶液體積不變)。
①二甲醚燃料電池的正極反應式為:___________,負極反應式為:_____________。
②請寫出電解食鹽水的化學方程式:____________________。
③電解后溶液的c(OH-)=________,理論上消耗二甲醚的質量為________(保留一位小數)。
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】將2molNaHCO3和一定量的Na2O2固體混合,在加熱條件下讓其充分反應后,對所得固體進行測定,發現Na2O2無剩余,則所得固體的物質的量(n)為
A.1mol<n<2molB.1mol<n<4mol
C.2mol<n≤4molD.1mol<n≤4mol
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】(1) KClO3 在 673K 時可分解為固體 A 和固體 B(物質的量之比為 3∶1),其中固體 A 所含元素與 KClO3 完全相同。寫出相應的化學反應方程式 ___。比較KClO3 和固體 A 的熱穩定性:KClO3_______固體 A(填“>”、“<”或“=”)。
(2)NaCN 各原子均滿足 8 電子穩定結構。寫出 NaCN 的電子式_________。
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】輝鉬礦主要含MoS2,還含有Ca、Si、Cu、Zn、Fe等元素。利用輝鉬礦制備仲鉬酸銨的新一代清潔生產工藝如下圖所示:
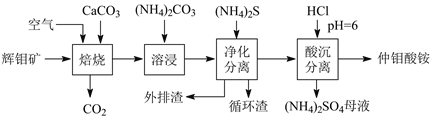
回答下列問題:
(1)焙燒溫度為400℃,MoS2轉化為CaMoO4和CaSO4,則反應中每摩MoS2轉移的電子數為_________。仲鉬酸銨(七鉬酸銨)中的陰離子是Mo7O24n-,則n=_______。
(2)傳統焙燒是在650℃下,使MoS2直接與空氣中的O2反應生成MoO3和SO2。圖示清潔生產工藝加入CaCO3的優點是______________。
(3)溶浸時,CaMoO4發生復分解反應的化學方程式是___________。循環渣的主要成分是CaCO3,則外排渣主要是________和Cu、Zn、Fe的硫化物。
(4)已知:常溫下Ksp(CaCO3)=2.8×10-9,Ksp(CaSO4)=9.1×10-6。在(NH4)2SO4母液中添加循環渣(CaCO3),可以使硫酸銨轉化為碳酸銨(返回溶浸循環使用),原因是_______。
(5)電氧化分解鉬精礦時,用惰性電極電解鉬精礦和NaCl的混合漿液,電解槽無隔膜,控制溶液pH=9。陰極生成物為________,混合漿液中,陽極產物轉化生成的NaClO氧化MoS2生成MoO42-和SO42-的離子方程式是______________。
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】Mg-VOCl2電池是一種基于陰離子傳導的新型二次電池,其簡化裝置示意圖如下。總反應為Mg+2VOCl2![]() MgCl2+2VOCl,下列說法錯誤的是
MgCl2+2VOCl,下列說法錯誤的是

A.采用Mg作電極材料比Li的安全性更高
B.為該電池充電時Mg電極應與電源的正極相連
C.放電時正極反應為VOCl2+e-= VOCl+Cl-
D.放電過程中Cl-穿過復合離子液體向Mg移動
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】甲醇是一種常見的燃料,也是重要的基礎化工原料。回答下列問題:
(1)采用甲醇氣相氨化法可制得二甲胺。
已知:2CH3OH(g)+3O2(g) 2CO2(g)+4H2O(g) H1=-3122kJ/mol
4NH3(g)+3O2(g) 2N2(g)+6H2O(g) H2=-472 kJ/mol
4(CH3)2NH(g)+15O2(g) 8CO2(g)+14H2O(g)+2N2(g) H3=-7492 kJ/mol
則制備二甲胺反應2CH3OH(g)+NH3(g) (CH3)2NH(g)+2H2O(g)的H=_____ kJ/mol。
(2)一定條件下,甲醇氣相氨化法原料氣中c(CH3OH):c(NH3)分別為1:1、2:1、3:1時,NH3的平衡轉化率隨溫度變化的關系如圖:
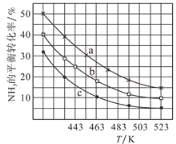
①代表原料氣中c(CH3OH):c(NH3)=1:1的曲線是________。
②一定溫度下,控制原料氣中c(CH3OH):c(NH3)=3:1,能增大NH3平衡轉化率的措施是_______。
③溫度為443K時,按c(CH3OH):c(NH3)=2:1投料,若NH3的起始濃度為2mol/L,則反應達到平衡時,(CH3)2NH的體積分數為_______,該溫度下的化學平衡常數為________ 。
(3)甲醇可通過電化學方法由甲烷直接制得,裝置如下圖所示,電解生成CH3OH的過程分為3步:

①通電時,氯離子先轉化為高活性的原子氯(Cl·);
②Cl·與吸附在電極上的CH4反應生成HCl和CH3Cl;
③在堿性電解液中,CH3Cl轉化為目標產物CH3OH。
步驟①的電極反應式為__________,步驟③的離子方程式為__________,維持電流強度為1.5A,裝置工作2小時,理論上可制得CH3OH的質量為________g。(已知F=96500C/mol,不考慮氣體溶解等因素)
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】有機物A的鍵線式結構為![]() ,有機物B與等物質的量的H2發生加成反應可得到有機物A。下列有關說法錯誤的是( )
,有機物B與等物質的量的H2發生加成反應可得到有機物A。下列有關說法錯誤的是( )
A.有機物A的分子式為C8H18
B.用系統命名法命名有機物A,名稱為2,2,3-三甲基戊烷
C.有機物A的一氯代物只有4種
D.B的結構可能有3種,其中一種的名稱為3,4,4-三甲基-2-戊烯
查看答案和解析>>
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com