分析:(1)當向100mL 0.1mol/L的NaOH溶液中通入一定量的CO
2氣體后,可能發生的反應有:2NaOH+CO
2═Na
2CO
3+H
2O或NaOH+CO
2═NaHCO
3兩種可能的情況,通過圖象關系,當向溶液中加鹽酸的體積30mL時,無氣體出現,說明此段內發生了如下反應:NaOH+HCl=NaCl+H
2O或HCl+Na
2CO
3═NaHCO
3+NaCl;當加入50mL鹽酸時生成的二氧化碳達到最大量,反應結束,此時溶質為氯化鈉,可以根據氯原子、鈉原子守恒計算出消耗氯化氫的總物質的量,再根據c=
計算出該稀鹽酸的濃度;
(2)生成二氧化碳氣體的反應方程式為:NaHCO
3+HCl═CO
2↑+NaCl,根據圖象可知生成二氧化碳總共消耗該稀鹽酸20mL,根據n=cV計算出氯化氫的物質的量,再根據反應方程式計算出生成二氧化碳的物質的量,再根據V=nV
m計算出生成的標況下的二氧化碳的體積;
(3)反應生成二氧化碳氣體前可能發生的反應有:Na
2CO
3+HCl═NaHCO
3+NaCl、NaOH+HCl=NaCl+H
2O,生成二氧化碳氣體的反應為:NaHCO
3+HCl═CO
2↑+NaCl,
根據圖象可知,反應生成二氧化碳氣體前消耗了30mL鹽酸,反應生成二氧化碳消耗了20mL鹽酸,說明氫氧化鈉溶液與二氧化碳反應后的溶液中溶質為NaOH和Na
2CO
3,
根據生成二氧化碳的物質的量及碳原子守恒可以計算出碳酸鈉的物質的量,根據二者生成二氧化碳氣體前消耗氯化氫的物質的量可以計算出氫氧化鈉的物質的量,再根據c=
計算出二者的物質的量濃度.
解答:
解:(1)當向100mL 0.1mol/L的NaOH溶液中通入一定量的CO
2氣體后,可能發生的反應有:2NaOH+CO
2═Na
2CO
3+H
2O或NaOH+CO
2═NaHCO
3兩種可能的情況,通過圖象關系,當向溶液中加鹽酸的體積30mL時,無氣體出現,說明此段內發生了如下反應:NaOH+HCl=NaCl+H
2O或HCl+Na
2CO
3═NaHCO
3+NaCl;當加入50mL鹽酸時生成的二氧化碳達到最大量,反應結束,此時溶質為氯化鈉,
根據氯原子、鈉原子守恒可得:HCl~NaCl~NaOH,所以反應消耗鹽酸的物質的量為:n(HCl)=n(NaOH)=0.1mol/L×0.1L=0.01mol,該稀鹽酸的濃度為:c(HCl)=
=0.2mol/L,
答:該稀鹽酸的物質的量濃度為0.2mol/L;
(2)生成二氧化碳氣體的反應為:NaHCO
3+HCl═CO
2↑+NaCl,根據圖象可知生成二氧化碳總共消耗該稀鹽酸體積為:(50-30)mL=20mL,消耗氯化氫的物質的量為:n(HCl)=0.2mol/L×0.02L=0.004mol,
根據反應NaHCO
3+HCl═CO
2↑+NaCl可知,生成二氧化碳的物質的量為0.004mol,
標況下0.004mol二氧化碳的體積為:22.4L/mol×0.004mol=89.6mL,
故答案為:生成標況下二氧化碳的體積為89.6mL;
(3)反應生成二氧化碳氣體前可能發生的反應有:Na
2CO
3+HCl═NaHCO
3+NaCl、NaOH+HCl=NaCl+H
2O,生成二氧化碳氣體的反應為:NaHCO
3+HCl═CO
2↑+NaCl,
根據圖象可知,反應生成二氧化碳氣體前消耗了30mL鹽酸,反應生成二氧化碳過程中消耗了20mL鹽酸,說明滴加鹽酸前溶液中所含溶質為NaOH和Na
2CO
3,
根據C原子守恒,碳酸鈉的物質的量為:n(Na
2CO
3)=n(CO
2)=0.004mol,
0.004mol碳酸鈉發生反應Na
2CO
3+HCl═NaHCO
3+NaCl消耗氯化氫的物質的量為:0.004mol,
則NaOH消耗氯化氫的物質的量為:0.2mol/L×0.03L-0.004mol=0.002mol,根據反應NaOH+HCl=NaCl+H
2O可知,反應消耗的氫氧化鈉的物質的量為0.002mol,
則滴加鹽酸前溶液中所含溶質的成分為Na
2CO
3、NaOH,濃度分別為:c(Na
2CO
3)=
=0.4mol/L,c(NaOH)=
=0.2mol/L,
答:滴加鹽酸前溶液中所含溶質的成分為Na
2CO
3、NaOH,濃度分別為:c(Na
2CO
3)=0.4mol/L,c(NaOH)=0.2mol/L.

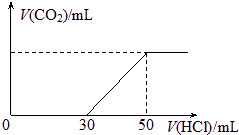 標況下,在100 mL 0.1mol?L-1某NaOH溶液中通入一定量CO2后,再向所得溶液中滴加某濃度的稀鹽酸,滴加鹽酸的體積與生成氣體的情況如圖所示.(假設生成的CO2全部逸出).求:
標況下,在100 mL 0.1mol?L-1某NaOH溶液中通入一定量CO2后,再向所得溶液中滴加某濃度的稀鹽酸,滴加鹽酸的體積與生成氣體的情況如圖所示.(假設生成的CO2全部逸出).求:

 常溫下,Ksp(CaSO4)=9×l0-6,常溫下CaSO4在水中的沉淀溶解平衡曲線如圖.下列判斷錯誤的是( )
常溫下,Ksp(CaSO4)=9×l0-6,常溫下CaSO4在水中的沉淀溶解平衡曲線如圖.下列判斷錯誤的是( ) 已知二硫化碳(CS2)在常溫下呈液態,將其在氧氣中燃燒生成二氧化碳和二氧化硫.常溫下,按如圖所示配好裝置,待內外空氣壓強相等時,水銀柱液面在A處.取下橡皮塞,在玻璃燃燒匙中加入二硫化碳,用酒精燈點燃,并迅速移入錐形瓶中,再塞緊橡皮塞,二硫化碳安靜地燃燒,A處水銀柱液面下降.
已知二硫化碳(CS2)在常溫下呈液態,將其在氧氣中燃燒生成二氧化碳和二氧化硫.常溫下,按如圖所示配好裝置,待內外空氣壓強相等時,水銀柱液面在A處.取下橡皮塞,在玻璃燃燒匙中加入二硫化碳,用酒精燈點燃,并迅速移入錐形瓶中,再塞緊橡皮塞,二硫化碳安靜地燃燒,A處水銀柱液面下降.