
 ,答:
,答: ;
;| 4.48L |
| 22.4L/mol |
| ||
| 87 |
| x |
| 4 |
| y |
| 1 |
| 2mol |
| 0.8mol |
| 2 |
| 0.8mol+1mol/L×0.1L |
| 0.1L |


 閱讀快車系列答案
閱讀快車系列答案科目:高中化學 來源: 題型:閱讀理解
 已知KMnO4、MnO2在酸性條件下均能將草酸鈉(Na2C2O4)氧化:
已知KMnO4、MnO2在酸性條件下均能將草酸鈉(Na2C2O4)氧化:查看答案和解析>>
科目:高中化學 來源: 題型:
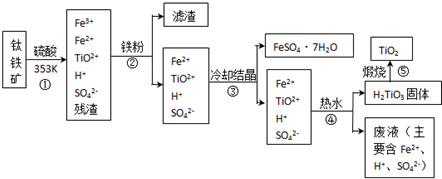
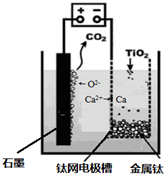
查看答案和解析>>
科目:高中化學 來源: 題型:

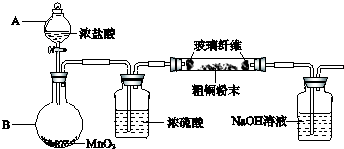
| ||
| ||
 CuCl42-(aq)+4H2O(l)
CuCl42-(aq)+4H2O(l)c(Cu
| ||
c[Cu
|
c(Cu
| ||
c[Cu
|
查看答案和解析>>
科目:高中化學 來源: 題型:

| ||
| ||
| 實驗步驟 | 實驗現象 | 用化學用語解釋 |
| 將少量氣體通入淀粉KI溶液 | 溶液最初變成 藍 藍 色 |
Cl2+2I-=I2+2Cl- Cl2+2I-=I2+2Cl- (用離子方程式表示) |
| 繼續通入氣體 | 溶液逐漸變成無色 | 5Cl2+I2+6H2O=2HIO3+10HCl 5Cl2+I2+6H2O=2HIO3+10HCl (用化學方程式表示) |
查看答案和解析>>
科目:高中化學 來源: 題型:閱讀理解

| ||
| ||
| 實驗步驟 | 預期現象和結論 |
| 步驟l:取c中的少量固體樣品于試管中,滴加足量蒸餾 水至同體溶解,然后將所得溶液分別置于a、b試管中. |
無明顯現象 無明顯現象 |
| 步驟2: 向A試管中滴加適量BaCl2溶液 向A試管中滴加適量BaCl2溶液 |
a.若無明顯現象,證明固體中不含Na2CO3 b.若溶液變渾濁,證明固體中含Na2CO3 a.若無明顯現象,證明固體中不含Na2CO3 b.若溶液變渾濁,證明固體中含Na2CO3 |
| 步驟3: 向B試管中滴加過量的稀硝酸,再滴加AgNO3溶液 向B試管中滴加過量的稀硝酸,再滴加AgNO3溶液 |
若溶液變渾濁,證明固體中含有NaCl 若溶液變渾濁,證明固體中含有NaCl |
查看答案和解析>>
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com