
一定溫度下,向1.0L密閉容器中加入0.60molX(g),發生反應X(g)  Y(s)+2Z(g)△H>0測得反應物X濃度與反應時間的數據如下表
Y(s)+2Z(g)△H>0測得反應物X濃度與反應時間的數據如下表
|
反應時間t/min |
0 |
1 |
2 |
3 |
4 |
6 |
8 |
|
c(X)/(mol·L-1) |
0.60 |
0.42 |
0.30 |
0.21 |
0.15 |
a |
0.0375 |
(1)3min時用Z表示的平均反應速率v(Z)= 。
(2)分析該反應中反應物的濃度與時間的規律,得出的結論是 。由此規律推出反應在6min時反應物的濃度a為 mol·L-1。
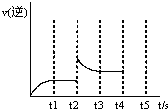
(3)反應的逆反應速率隨時間變化的關系如圖,t2時改變了某一種條件,改變的條件可能是 、 (填寫兩頂)

(4)下列哪些情況表明容器中已達平衡狀態 (填字母序號)
A.容器體積一定時氣體密度不再變化
B.反應的平衡常數不再變化
C.容器中氣體的平均相對分子質量不隨時間而變化
D.Y的物質的量不再發生變化
E.Z的生成速率等于X的消耗速率的2倍
(10分)
(1)0.26mol·L-1·min-1(2分)
(2)每間隔2min,X的濃度為原來的一半(2分);0.075(2分)
(3)加入Z 增大體系的壓強(2分)
(4)ACD(2分)
【解析】
試題分析:
3min是△c(X)=0.39mol·L-1,v(X)=0.39mol·L-1/3min=0.13mol·L-1·min-1,而2v(X)=v(Z)= 0.26mol·L-1·min-1。
根據題中數據,可見每間隔2min,X的濃度為原來的一半;由此規律推出反應在6min時反應物的濃度a為0.075 mol·L-1
t2時刻,v逆增大,可能的因素為加入生成物Z或增大體系的壓強。
A、生成物Y是固體,未建立平衡時氣體總質量在變化,密度也在變化,達平衡是不再變化,故可以說明,正確;B、平衡常數只與溫度有關,錯誤;C、左右兩邊氣體分子質量不同,只有平衡時氣體的平均相對分子質量不隨時間而變化,正確;D、Y的量不在變化,達到平衡,正確;E、2倍的Z的生成速率等于X的消耗速率才是平衡態,錯誤。
考點:本題考查化學反應速率、影響速率的因素、平衡的特征等相關知識。


 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小學生10分鐘應用題系列答案
小學生10分鐘應用題系列答案科目:高中化學 來源: 題型:
| c(CH3COO-)?c(H+) | c(CH3COOH) |
查看答案和解析>>
科目:高中化學 來源: 題型:
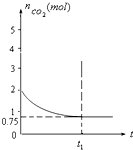 一定溫度下,向1升的恒容容器中加入2moL碳和2moLCO2,反應為:
一定溫度下,向1升的恒容容器中加入2moL碳和2moLCO2,反應為:查看答案和解析>>
科目:高中化學 來源: 題型:
| 反應時間t/min | 0 | 1 | 2 | 3 | 4 | 6 | 8 |
| c(X)/(mol?L-1) | 0.60 | 0.42 | 0.30 | 0.21 | 0.15 | a | 0.0375 |
查看答案和解析>>
科目:高中化學 來源:2013屆遼寧省實驗中學分校高三12月月考化學試卷(帶解析) 題型:填空題
(10分)硫—碘循環分解水制氫主要涉及下列反應:
Ⅰ. SO2+2H2O+I2===H2SO4+2HI
Ⅱ. 2HI H2+I2
H2+I2
Ⅲ. 2H2SO4===2SO2+O2+2H2O
(1) 分析上述反應,下列判斷正確的是 。
a.反應Ⅲ易在常溫下進行
b.反應Ⅰ中SO2氧化性比HI強
c.循環過程中需補充H2O
d.循環過程產生1 mol O2的同時產生1 mol H2
(2) 一定溫度下,向1 L密閉容器中加入1 mol HI(g),發生反應Ⅱ,H2物質的量隨時間的變化如圖所示。
① 0~2 min內的平均反應速率v(HI)= 。
② 該溫度下,H2(g)+I2(g) 2HI(g)的平衡常數K= 。
2HI(g)的平衡常數K= 。
③ 相同溫度下,若開始加入HI(g)的物質的量是原來的2倍,則 是原來的2倍。
a.平衡常數 b.HI的平衡濃度
c.達到平衡的時間 d.平衡時H2的體積分數
(3) 實驗室用Zn和稀硫酸制取H2,反應時若加入少量下列試劑中的 ,產生H2的速率將增大。
a.NaNO3 b.CuSO4 c.Na2SO4 d.NaHSO3
查看答案和解析>>
科目:高中化學 來源:2011屆天津市南開區高三一模考試(理綜)化學部分 題型:填空題
(14分)能源開發、環境保護、資源利用等是當今社會的熱門話題。請根據所學化學知識回答下列問題:
(1)汽車上安裝催化轉化器,可使汽車尾氣中的主要污染物(CO、NOx、碳氫化合物)進行相互反應,生成無毒物質,減少汽車尾氣污染。
已知:N2(g) + O2(g)=2NO(g) △H=+180.5 kJ · mol-1;
2C(s)+ O2(g)=2CO(g) △H=-221.0 kJ · mol-1;
C(s)+ O2(g)=CO2(g) △H=-393.5 kJ · mol-1
則尾氣轉化反應2NO(g) +2CO(g)=N2(g)+2CO2(g)的△H=________________。
(2)汽車尾氣分析儀對CO的含量分析是以燃料電池為工作原理,其裝置如下圖所示,該電池中電解質為氧化釔-氧化鈉,其中O2-可以在固體介質中自由移動。
下列說法中正確的是_____________(填字母序號)。
| A.負極的電極反應式為:CO + O2-―2e-=CO2 |
| B.工作時電子由電極a通過傳感器流向電極b |
| C.工作時電極b作正極,O2-由電極a通過固體介質向電極b遷移 |
| D.傳感器中通過的電流越大,尾氣中CO的含量越高 |
 CH3OH(g),經10 min反應達到平衡時測得各組分的濃度如下:
CH3OH(g),經10 min反應達到平衡時測得各組分的濃度如下:| 物 質 | CO | H2 | CH3OH |
| 濃度/(mol·L-1) | 1.2 | 1.0 | 0.6 |
查看答案和解析>>
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com