
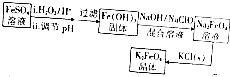
分析 根據反應的流程可知,硫酸亞鐵被雙氧水氧化,再調節pH值可得氫氧化鐵固體,氫氧化鐵固體在堿性條件下被次氯酸鈉氧化得Na2FeO4溶液,在溶液中加入氯化鉀結晶可得K2FeO4,
(1)在保存硫酸亞鐵溶液時要防止亞鐵離子水解;
(2)氫氧化鐵與次氯酸鈉反應生成高鐵酸鈉和氯化鈉,利用元素守恒和電子得失守恒書寫化學方程式;
(3)根據在溶液中溶解大的物質可以生成溶解度小的物質的原理分析;
(4)調節pH使鐵離子沉淀完全,即c(Fe3+)≤1×10-5mol.L-1,根據Ksp[Fe(OH)3]=c(Fe3+)•c3(OH-)可計算出溶液中氫氧根離子的濃度,進而確定pH值;
(5)多元弱酸弱堿是分步電離的,所以弱堿陽離子也是分步水解的,其中一級水解程度大于二級水解,二級水解程度大于三級水解,據此判斷水解平衡常數的大小,溶液酸性過強會抑制鐵離子的水解.
解答 解:根據反應的流程可知,硫酸亞鐵被雙氧水氧化,再調節pH值可得氫氧化鐵固體,氫氧化鐵固體在堿性條件下被次氯酸鈉氧化得Na2FeO4溶液,在溶液中加入氯化鉀結晶可得K2FeO4,
(1)在保存硫酸亞鐵溶液時要防止亞鐵離子水解,所以加入少量的硫酸目的是抑制亞鐵離子的水解,
故答案為:抑制亞鐵離子的水解;
(2)氫氧化鐵與次氯酸鈉反應生成高鐵酸鈉和氯化鈉,反應方程式為2Fe(OH)3+3NaClO+4NaOH=2Na2FeO4+3NaCl+5H2O,
故答案為:2Fe(OH)3+3NaClO+4NaOH=2Na2FeO4+3NaCl+5H2O;
(3)高鐵酸鈉在溶液中溶解大于高鐵酸鉀,所以鐵酸鈉在溶液中可以轉化成高鐵酸鉀,
故答案為:高鐵酸鈉在溶液中溶解大于高鐵酸鉀;
(4)調節pH使鐵離子沉淀完全,即c(Fe3+)≤1×10-5mol.L-1,根據Ksp[Fe(OH)3]=c(Fe3+)•c3(OH-)可知溶液中c(OH-)=$\root{3}{\frac{1.0×10{\;}^{-34}}{1×1{0}^{-5}}}$=1×$1{0}^{-\frac{29}{3}}$,c(H+)=1×$1{0}^{-\frac{13}{3}}$,所以pH≈4.3,所以要使鐵離子完全沉淀,溶液的pH值大于4.3,
故答案為:大于4.3;
(5)多元弱酸弱堿是分步電離的,所以弱堿陽離子也是分步水解的,其中一級水解程度大于二級水解,二級水解程度大于三級水解,所以K1>K2>K3,溶液酸性過強會抑制鐵離子的水解,不能產生氫氧化鐵膠體,所以不利于凈水,
故答案為:K1>K2>K3;溶液酸性過強會抑制鐵離子的水解,不能產生氫氧化鐵膠體.
點評 本題主要考查化學工藝流程分析,意在考查考生對已學知識的掌握、理解、遷移、轉化、重組和解決實際問題的能力.


科目:高中化學 來源: 題型:解答題
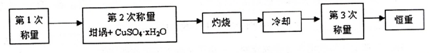

| 加熱前質量 | 加熱后質量 | ||
| m1 | m2 | m3 | m4 |
| 11.721g | 22.692g | 18.631g | a |
查看答案和解析>>
科目:高中化學 來源: 題型:解答題

查看答案和解析>>
科目:高中化學 來源: 題型:多選題
| A. | 向某無色溶液中加入鐵粉能產生大量H2,則該溶液中存在大量Na+、Ca2+、C1-、NO3- | |
| B. | 水電離出的c(H+)=1×10-3mol•L-1的水溶液中Na+、CO32-、Cl-、K+ | |
| C. | pH=1的水溶液中NH4+、Cl-、Mg2+、SO42- | |
| D. | Al3+、HCO3-、I-、Ca2+ |
查看答案和解析>>
科目:高中化學 來源: 題型:解答題
查看答案和解析>>
科目:高中化學 來源: 題型:解答題
查看答案和解析>>
科目:高中化學 來源: 題型:解答題
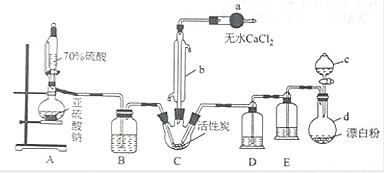 氯化法是合成硫酰氯(SO2Cl2)的常用方法,實驗室合成硫酰氯(SO2Cl2)的實驗裝置如圖所示:
氯化法是合成硫酰氯(SO2Cl2)的常用方法,實驗室合成硫酰氯(SO2Cl2)的實驗裝置如圖所示:查看答案和解析>>
科目:高中化學 來源: 題型:多選題
| A. | 1 mol•L-1 HCN溶液的pH約為3 | |
| B. | HCN易溶于水 | |
| C. | 10 mL 1 mol•L-1 HCN溶液恰好與10 mL 1 mol•L-1NaOH溶液完全反應 | |
| D. | 在相同條件下,HCN溶液的導電性比強酸溶液的弱 |
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| A. | ①② | B. | ③⑥ | C. | ④⑤ | D. | ②④ |
查看答案和解析>>
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com