
【題目】如圖中A到F是化合物,且A、B、E、F均含鈉元素,G是單質.

(1)寫出A、B、E、F的化學式:A________,B________,E________,F________.
(2)寫出反應①②③的化學方程式:① _____________________________② _________________________________③__________________________________
【答案】 NaHCO3 Na2CO3 Na2O2 NaOH 2NaHCO3![]() Na2CO3+CO2↑+H2O NaHCO3 + NaOH ==Na2CO3 + H2O Na2CO3 + CO2 +H2O ==2NaHCO3
Na2CO3+CO2↑+H2O NaHCO3 + NaOH ==Na2CO3 + H2O Na2CO3 + CO2 +H2O ==2NaHCO3
【解析】轉化關系中A到F是化合物,且A、B、E、F均含鈉元素,G是單質,E與C、D反應均能得到單質G,應是過氧化鈉與水、二氧化碳的反應,可推知E為Na2O2、G為O2,而A分解得到B、C、D,可推知A為NaHCO3,則B為Na2CO3,碳酸鈉能夠與C反應生成碳酸氫鈉,則C為CO2,D為H2O,F為NaOH。
(1)由上述分析可知,A為NaHCO3,B為Na2CO3,E為Na2O2,F為NaOH,故答案為:NaHCO3;Na2CO3;Na2O2;NaOH;
(2)反應①是碳酸氫鈉分解生成碳酸鈉、二氧化碳與水,反應方程式為:2NaHCO3![]() Na2CO3+CO2↑+H2O;反應②是碳酸氫鈉與氫氧化鈉反應生成碳酸鈉與水,反應方程式為:NaHCO3+NaOH=Na2CO3+H2O;反應③是碳酸鈉與二氧化碳、水反應生成碳酸氫鈉,反應方程式為:Na2CO3+CO2+H2O=2NaHCO3,故答案為:2NaHCO3
Na2CO3+CO2↑+H2O;反應②是碳酸氫鈉與氫氧化鈉反應生成碳酸鈉與水,反應方程式為:NaHCO3+NaOH=Na2CO3+H2O;反應③是碳酸鈉與二氧化碳、水反應生成碳酸氫鈉,反應方程式為:Na2CO3+CO2+H2O=2NaHCO3,故答案為:2NaHCO3![]() Na2CO3+CO2↑+H2O;NaHCO3+NaOH=Na2CO3+H2O;Na2CO3+CO2+H2O=2NaHCO3。
Na2CO3+CO2↑+H2O;NaHCO3+NaOH=Na2CO3+H2O;Na2CO3+CO2+H2O=2NaHCO3。


 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小學生10分鐘應用題系列答案
小學生10分鐘應用題系列答案科目:高中化學 來源: 題型:
【題目】肼(N2H4)是一種無色易溶于水的油狀液體。具有堿性和極強的還原性,在工業生產中應用非常廣泛。

(1)已知肼的球棍棋型如圖1所示,試寫出肼的電子式:________。
(2)目前正在研發的一種肼燃料電池的結構如圖2所示。________(填“a”或“b”)電極為電池的負極。
(3)在1L固定體積的容器中加入0.1molN2H4,在303K、Pt催化下發生:N2H4(I)![]() N2(g)+2H2(g),測得容器中
N2(g)+2H2(g),測得容器中![]() 與時間關系如圖3所示,則04min氮氣的平均速率v(N2)=________。
與時間關系如圖3所示,則04min氮氣的平均速率v(N2)=________。
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】常溫下,下列說法正確的是
A. AgCl固體在等物質的量濃度的NaCl、MgCl2溶液中的溶度積相同
B. 在0.1mol/L的NaOH溶液中,由水電離出的c(H+)>![]()
C. 將NH4Cl溶液從20 ℃升溫至30 ℃,溶液中![]() 增大
增大
D. CH3COONa和鹽酸兩溶液混合后,呈中性的混合溶液中:c(Na+)=c(Cl-)>c(CH3COOH)
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】如圖,A、B、C、D、E各代表水、鐵、二氧化碳、硫酸銅溶液、氫氧化鋇溶液中的一種物質。常溫下,相連環物質間能發生反應,不相連環物質間不能發生反應,且B的相對分子質量大于D。請填空:

(1)寫出下列物質的化學式:A_______,B_______,D_______。
(2)寫出下列反應的化學方程式:B+C:________________________________________,
(3)相連環物質間發生的反應中,置換反應共有____________個。
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】近年華北地區頻繁的霧霾天氣已經引起人們的高度重視,化學反應原理可用于治理環境污染,請回答下列問題:
(1)一定條件下,可以用CO處理燃煤煙氣生成液態硫,實現硫的回收。
①已知:2CO(g)+O2(g) = 2CO2(g) ΔH= -566 kJ·mol-1
S(l) +O2(g) = SO2(g) ΔH=-296 kJ·mol-1
則用CO處理燃煤煙氣的熱化學方程式是_____________________。
②在一定溫度下,在2 L密閉容器中投入2 mol CO、l mol SO2發生上述反應,達到化學平衡時SO2的轉化率為90%,則該溫度下該反應的平衡常數K的數值為____________。
(2)SNCR—SCR是一種新型的煙氣脫硝技術(除去煙氣中的NOx),其流程如下:
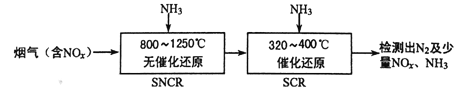
已知該方法中主要反應的熱化學方程式:4NH3(g)+4NO(g)+O2(g)![]() 4N2(g)+6H2O(g) ΔH=-1646 kJ·mol-1,在一定溫度下,在密閉恒壓的容器中,能表示上述反應達到化學平衡狀態的是__________________(填字母)。
4N2(g)+6H2O(g) ΔH=-1646 kJ·mol-1,在一定溫度下,在密閉恒壓的容器中,能表示上述反應達到化學平衡狀態的是__________________(填字母)。
a. 4v逆(N2) = v正(O2)
b.混合氣體的密度保持不變
c. c(N2)∶c(H2O)∶c(NH3)=4∶6∶4
d.單位時間內斷裂4 mol N-H鍵的同時斷裂4 mol![]() 鍵
鍵
(3)如圖所示,反應溫度會直接影響SNCR技術的脫硝效率。
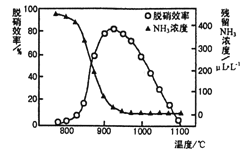
①SNCR技術脫硝的最佳溫度選擇925 ℃的理由是_____________。
②SNCR與SCR技術相比,SNCR技術的反應溫度較高,其原因是________________;但當煙氣溫度高于1000℃時,SNCR脫硝效率明顯降低,其原因可能是__________________。
(4)一種三室微生物燃料電池可用于污水凈化、海水淡化,其工作原理如圖所示:
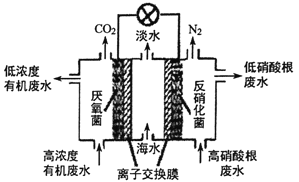
①中間室的Cl-移向_________(填“左室”或“右室”),處理后的含硝酸根廢水的pH__________(填“降低”或“升高”)
②若圖中有機廢水中有機物用C6H12O6表示, 請寫出左室發生反應的電極反應式:_________________。
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】臭氧是理想的煙氣脫硝劑,其脫硝反應為2NO2(g)+O3(g)![]() N2O5(g)+O2(g),在T溫度下,向2.0 L恒容密閉容器中充入2.0 mol NO2和1.0 mol O3,經過一段時間后達到平衡。反應過程中測定的部分數據見下表:
N2O5(g)+O2(g),在T溫度下,向2.0 L恒容密閉容器中充入2.0 mol NO2和1.0 mol O3,經過一段時間后達到平衡。反應過程中測定的部分數據見下表:
t/s | 0 | 3 | 6 | 12 | 24 |
n(O2)/mol | 0 | 0.36 | 0.60 | 0.80 | 0.80 |
下列有關說法正確的是
A. 反應在0~3 s內的平均速率v(NO2)=0.24 mol·L-1·s-1
B. 24 s后,若保持其他條件不變,降低溫度,達到新平衡時測得c(O2)=0.44 mol·L-1,則反應的ΔH>0
C. 在T溫度下,起始時向容器中充入2.0 mol N2O5和2.0 mol O2,達到平衡時,N2O5的轉化率大于20%
D. 在T溫度下,起始時向容器中充入1.0 mol NO2、0.5 mol O3和0.50 mol N2O5、0.50 mol O2,反應達到平衡時,壓強為起始時的0.88倍
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】將盛有12mLNO2和O2的混合氣體的量筒倒立于水槽中,充分反應后,還剩余2mL氣體,則原混合氣體中O2的體積是
A. 2mL B. 2.4mL C. 3.6mL D. 4mL
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】(2017·浙江省溫州中學高三3月模擬)以下是對某水溶液進行離子檢驗的方法和結論,其中正確的是
A.先加入BaCl2溶液,再加入足量的HNO3溶液,產生了白色沉淀。溶液中一定含有大量的![]()
B.加入足量的CaCl2溶液,產生了白色沉淀。溶液中一定含有大量的![]()
C.加入足量濃 NaOH溶液,產生了帶有強烈刺激性氣味的氣體,該氣體可以使濕潤的紅色石蕊試紙變藍,則溶液中一定含有大量的![]()
D.先加適量的鹽酸將溶液酸化,再加AgNO3溶液,產生了白色沉淀。溶液中一定含有大量的Cl
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】關于硝酸的說法正確的是( )
A. Cu可以溶解在稀硝酸中并生成H2
B. 濃HNO3不能與非金屬單質反應
C. 硝酸與金屬反應時,主要是+5價的氮元素得電子
D. 常溫下,向濃HNO3中投入Fe片,會產生大量的紅棕色氣體
查看答案和解析>>
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com