


 直通貴州名校周測月考直通名校系列答案
直通貴州名校周測月考直通名校系列答案科目:高中化學 來源: 題型:閱讀理解
| T/K | 303 | 313 | 323 |
| NH3生成量/(10-6mol) | 4.8 | 5.9 | 6.0 |
 NH3H2O+H+
NH3H2O+H+ NH3H2O+H+
NH3H2O+H+查看答案和解析>>
科目:高中化學 來源: 題型:閱讀理解
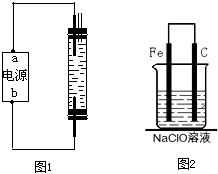 (2010?煙臺一模)2008年5月12日我國四川汶川發生特大地震,為防止在大災之后疫病流行,全國各地向災區運送了大量的各種消毒液,如NaClO溶液.某校探究性學習小組對消毒液次氯酸鈉(NaClO)的制備與性質等進行了探究.
(2010?煙臺一模)2008年5月12日我國四川汶川發生特大地震,為防止在大災之后疫病流行,全國各地向災區運送了大量的各種消毒液,如NaClO溶液.某校探究性學習小組對消毒液次氯酸鈉(NaClO)的制備與性質等進行了探究.查看答案和解析>>
科目:高中化學 來源: 題型:閱讀理解
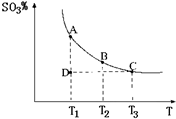 (2011?松江區模擬)運用化學反應原理研究氮、硫、氯、碘等單質及其化合物的反應有重要意義.
(2011?松江區模擬)運用化學反應原理研究氮、硫、氯、碘等單質及其化合物的反應有重要意義. 2SO3(g),混合體系中SO3的百分含量和溫度的關系如圖所示(曲線上任何一點都表示平衡狀態).根據圖示回答下列問題:
2SO3(g),混合體系中SO3的百分含量和溫度的關系如圖所示(曲線上任何一點都表示平衡狀態).根據圖示回答下列問題: 2SO3(g)是
2SO3(g)是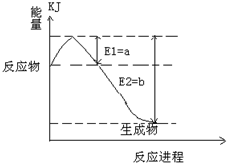
查看答案和解析>>
科目:高中化學 來源: 題型:閱讀理解

| 10-7b |
| a-b |
| 10-7b |
| a-b |
查看答案和解析>>
科目:高中化學 來源: 題型:
 研究化學反應原理對于生產、生活及環境保護具有重要意義.
研究化學反應原理對于生產、生活及環境保護具有重要意義.查看答案和解析>>
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com