
 某化學小組采用類似制乙酸乙酯的裝置(如圖),以環己醇制備環己烯
某化學小組采用類似制乙酸乙酯的裝置(如圖),以環己醇制備環己烯
| 密度(g/cm3) | 熔點 (℃) | 沸點 (℃) | 溶解性 | |
| 環已醇 | 0.96 | 25 | 161 | 能溶于水 |
| 環已烯 | 0.81 | -103 | 83 | 難溶于水 |
分析 (1)①根據實驗室制乙烯可知,發生裝置A中碎瓷片的作用是防止暴沸;導管B比較長,能增加與空氣的接觸面積,其作用是導氣和將生成的氣體物質冷凝回流;
②冰水浴的目的是降低環己烯蒸氣的溫度,使其液化;
(2)環己烯不溶于氯化鈉溶液,且密度比水小,分層后環己烯在上層,由于分液后環己烯粗品中還含有少量的酸和環己醇,聯想:制備乙酸乙酯提純產物時用c(Na2CO3溶液)洗滌可除去酸.
解答 解:(1)①根據實驗室制乙烯可知,發生裝置A中碎瓷片的作用是防止暴沸,導管B比較長,能增加與空氣的接觸面積,其作用是導氣和將生成的氣體物質冷凝回流;
故答案為:防止暴沸;冷凝回流;
②冰水浴的目的是降低環己烯蒸氣的溫度,使其液化,
故答案為:進一步冷卻,防止環己烯揮發;
(2)環己烯是烴類,不溶于氯化鈉溶液,且密度比水小,振蕩、靜置、分層后環己烯在上層;環己烯中含有碳碳雙鍵,可以被KMnO4溶液氧化,稀H2SO4不能除去,反而能引入新的酸性雜質,只有Na2CO3溶液,不能與環己烯反應,可以與酸性雜質反應,可選;
故答案為:上;c.
點評 本題以有機合成為載體,綜合考查了環己烯的制備,考查了學生運用知識的能力,題目難度中等,注意把握實驗原理和方法,特別是實驗的基本操作,學習中注意積累.


科目:高中化學 來源: 題型:選擇題
| A. | 純水幾乎不導電,因此水是非電解質 | |
| B. | 在任何溫度下,純水的pH均等于7 | |
| C. | 向水中加入鈉,溶液中$\frac{{K}_{w}}{c(O{H}^{-})}$減小 | |
| D. | 向水中加入醋酸,c(H+)和水的電離均增大 |
查看答案和解析>>
科目:高中化學 來源: 題型:填空題
查看答案和解析>>
科目:高中化學 來源: 題型:解答題
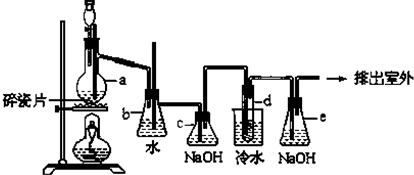
 對氨基苯磺酸是制取染料和一些藥物的重要中間體,可由苯胺與濃硫酸(HO-SO3H)磺化得到.實驗室可利用右圖裝置合成對氨基苯磺酸
對氨基苯磺酸是制取染料和一些藥物的重要中間體,可由苯胺與濃硫酸(HO-SO3H)磺化得到.實驗室可利用右圖裝置合成對氨基苯磺酸
| 苯胺 | 對氨基苯磺酸 | |
| 熔點 | -6.3℃ | 288℃ |
| 沸點 | 184℃ | (300℃開始分解炭化) |
| 水溶性 | 微溶于水 | 微溶于冷水、溶于熱水 |
 .
.查看答案和解析>>
科目:高中化學 來源: 題型:解答題
查看答案和解析>>
科目:高中化學 來源: 題型:解答題

查看答案和解析>>
科目:高中化學 來源: 題型:解答題

| 25℃時 | pH值 |
| 飽和H2S溶液 | 3.9 |
| SnS沉淀完全 | 1.6 |
| FeS開始沉淀 | 3.0 |
| FeS沉淀完全 | 5.5 |
查看答案和解析>>
科目:高中化學 來源: 題型:填空題
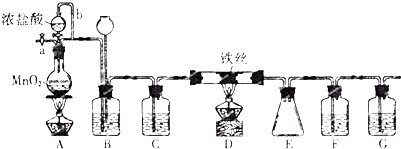
 工業上常利用含硫廢水生產Na2S2O3•5H2O,某小組同學用如下裝置(略去部分夾持儀器,氣密性已檢驗)模擬生產過程.實驗步驟是:先向C中燒瓶加入Na2S和Na2SO3混合溶液,再向A中燒瓶滴加濃H2SO4;待Na2S和Na2SO3完全消耗后,過濾C中混合物,濾液經結晶即得到產品.
工業上常利用含硫廢水生產Na2S2O3•5H2O,某小組同學用如下裝置(略去部分夾持儀器,氣密性已檢驗)模擬生產過程.實驗步驟是:先向C中燒瓶加入Na2S和Na2SO3混合溶液,再向A中燒瓶滴加濃H2SO4;待Na2S和Na2SO3完全消耗后,過濾C中混合物,濾液經結晶即得到產品.| 步驟 | 實驗操作 | 實驗現象 |
| I | 取適量產品配成稀溶液,滴加足量BaCl2溶液 | 有白色沉淀生成 |
| II | 過濾,用蒸餾水洗滌沉淀,向沉淀中加入 足量稀鹽酸 | 沉淀未完全溶解,并有刺激性氣味的氣體產生 |
查看答案和解析>>
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com