
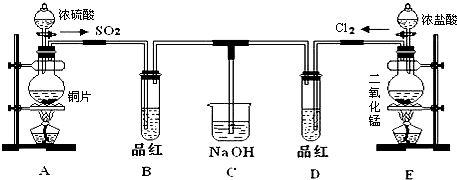
分析 (1)根據裝置圖可知,A中是銅與濃硫酸反應生成二氧化硫、硫酸銅和水,在該反應中濃硫酸既有氧化性又有酸性;
(2)實驗室用裝置E中二氧化錳與濃鹽酸加熱制備Cl2,同時生成氯化錳和水,根據化合價的變化可知,該反應中氯化氫中的氯從-1價變為0價,據此答題;
(3)①根據裝置圖可知,裝置A和E中,常用于萃取操作的儀器是分液漏斗;
②二氧化硫漂白后的物質具有不穩定性,而氯氣的漂白具有不可逆性;
(4)SO2和Cl2按1:1通入,SO2和Cl2恰好反應,二者反應生成H2SO4和HCl;
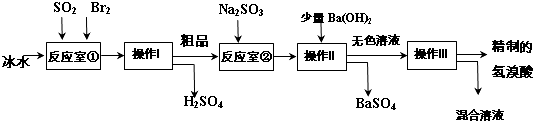
(5)Br2具有強氧化性,在溶液中將SO2氧化為H2SO4,反應室1中發生反應:SO2+Br2+2H2O=H2SO4+2HBr,Br2氧化SO2放出很多熱量,液溴、氫溴酸易揮發,反應室①使用冰水降低溫度,防止Br2和HBr揮發,操作I是將互溶的硫酸、氫溴酸分離,而氫溴酸易揮發,應采取蒸餾進行分離.粗品中可能含有揮發出的Br2,加入Na2SO3,除去粗品中未反應完的溴,再加入氫氧化鋇溶液,使反應生成SO42- 轉化硫酸鋇沉淀,再進行過濾分離,無色溶液中含有HBr及NaBr,再蒸餾得到精制的氫溴酸,④A用KSCN溶液檢驗Fe3+,滴加KSCN溶液,溶液變成血紅色;B由工藝流程可知,溶液中可能含有Br2,可以用CCl4萃取方法檢驗.
解答 解:(1)根據裝置圖可知,A中是銅與濃硫酸反應生成二氧化硫、硫酸銅和水,反應方程式為Cu+2H2SO4(濃) $\frac{\underline{\;\;△\;\;}}{\;}$CuSO4+SO2↑+2H2O,在該反應中濃硫酸既有氧化性又有酸性,
故答案為:Cu+2H2SO4(濃) $\frac{\underline{\;\;△\;\;}}{\;}$CuSO4+SO2↑+2H2O;既有氧化性又有酸性;
(2)實驗室用裝置E中二氧化錳與濃鹽酸加熱制備Cl2,同時生成氯化錳和水,反應的離子方程式為MnO2+4H++2Cl-$\frac{\underline{\;\;△\;\;}}{\;}$Mn2++Cl2↑+2H2O,根據化合價的變化可知,該反應中氯化氫中的氯從-1價變為0價,所以該反應中的還原劑是HCl,
故答案為:MnO2+4H++2Cl-$\frac{\underline{\;\;△\;\;}}{\;}$Mn2++Cl2↑+2H2O;HCl;
(3)①根據裝置圖可知,裝置A和E中,常用于萃取操作的儀器是分液漏斗,
故答案為:分液漏斗;
②二氧化硫漂白后的物質具有不穩定性,加熱時又能變為紅色,而氯氣的漂白具有不可逆性,加熱也不能恢復紅色,
故答案為:褪色的品紅恢復紅色;無明顯現象;
(4)SO2和Cl2按1:1通入,SO2和Cl2恰好反應,二者反應生成H2SO4和HCl,發生Cl2+SO2+2H2O=2HCl+H2SO4,不再具有漂白性,
故答案為:Cl2+SO2+2H2O=2HCl+H2SO4;
(5)①Br2氧化SO2放出很多熱量,液溴、氫溴酸易揮發,反應室①使用冰水降低溫度,防止Br2和HBr揮發,
故答案為:防止Br2和HBr揮發;
②操作I是將互溶的硫酸、氫溴酸分離,而氫溴酸易揮發,應采取蒸餾進行分離;操作Ⅱ分離固體與液體,應是過濾,
故答案為:蒸餾;過濾;
③粗品中可能含有揮發出的Br2,加入Na2SO3,還原除去粗品中的Br2,
故答案為:還原除去粗品中的Br2;
④A用KSCN溶液檢驗Fe3+:取少許溶液滴加KSCN溶液,溶液變成血紅色,說明氫溴酸呈淡黃色是因為含Fe3+,
故答案為:KSCN溶液;溶液變成血紅色;
B由工藝流程可知,溶液中可能溶解了少量Br2,可以用CCl4萃取方法檢驗:加入CCl4進行萃取,若觀察CCl4中有橙紅色液體出現,則可證明,
故答案為:溶解了少量Br2;加入CCl4進行萃取,若觀察CCl4中有橙紅色液體出現,則可證明.
點評 本題考查氯氣和二氧化碳漂白性的對比實驗,題目難度中等,本題注意二者的性質的異同,特別是漂白原理的不同.本題以制備氫溴酸為載體,考查學生對工藝流程的理解、物質的分離提純等基本操作、離子檢驗、物質性質等,難度中等,是對知識的綜合運用,需學生具有扎實的基礎知識與靈活運用知識解決問題的能力.


 一線名師提優試卷系列答案
一線名師提優試卷系列答案科目:高中化學 來源: 題型:選擇題
| A. | 氨基酸、淀粉均屬于高分子化合物 | |
| B. | 乙醇不能發生取代反應 | |
| C. | 苯能使溴水褪色是因為發生了加成反應 | |
| D. | 乙烯和甲烷可用溴的四氯化碳溶液鑒別 |
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
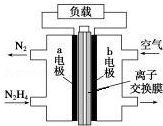 液體燃料電池相比于氣體燃料電池具有體積小等優點.一種以液態肼(N2H4)為燃料 的電池裝置如圖所示,該電池以空氣中的氧氣為氧化劑,以 KOH 溶液為電解質溶液.下列 關于該電池的敘述錯誤的是( )
液體燃料電池相比于氣體燃料電池具有體積小等優點.一種以液態肼(N2H4)為燃料 的電池裝置如圖所示,該電池以空氣中的氧氣為氧化劑,以 KOH 溶液為電解質溶液.下列 關于該電池的敘述錯誤的是( )| A. | b 極發生還原反應 | |
| B. | a 極的反應式為 N2H4-4e-═N2↑+4H+ | |
| C. | 放電時,電流從 b 極經過負載流向 a 極 | |
| D. | 其中的離子交換膜需選用陰離子交換膜 |
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| A. | 碘化鉀--加碘鹽 | B. | 氧化鋁--耐火材料 | ||
| C. | 鐵碳合金--碳素鋼 | D. | 硅酸鹽--普通玻璃 |
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| A. | 任何可逆反應都有一定的限度 | |
| B. | 對于反應2SO2(g)+O2(g)?2SO3(g)只有達到限度時才有2v(O2)=v(SO3) | |
| C. | 對于反應2SO2(g)+O2(g)?2SO3(g)達到限度時,增大容器容積能減小正反應速率 | |
| D. | 化學反應達到限度時,正逆反應速率相等 |
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| A. | H+、Cl-、NO3-、SiO32- | B. | Ag+、Fe3+、Cl-、SO42- | ||
| C. | K+、SO42-、Cu2+、NO3- | D. | NH4+、OH-、Cl-、HCO3- |
查看答案和解析>>
科目:高中化學 來源: 題型:解答題
查看答案和解析>>
科目:高中化學 來源: 題型:解答題
| t℃ | 700 | 800 | 830 | 1000 | 1200 |
| K | 0.6 | 0.9 | 1.0 | 1.7 | 2.6 |
查看答案和解析>>
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com