
【題目】化學反應原理在科研和生產中有廣泛應用。
(1)用生物質熱解氣(主要成分為CO、CH4、H2)將SO2在一定條件下還原為單質硫進行煙氣脫硫。已知:
①C(s)+O2(g)=CO2(g) △H1=-393.5 kJ·mol-1
②CO2(g)+C(s)=2CO(g) △H2= + 172.5 kJ·mol-1
③S(s)+O2(g)=SO2(g) △H3=- 296.0 kJ·mol-1
CO將SO2 還原為單質硫的熱化學方程式為_____________________________________。
(2)CO可用于合成甲醇,一定溫度下,向體積為2 L的密閉容器中加入CO和H2,發生反應CO(g)+2H2(g)![]() CH3OH(g),達到平衡后測得各組分的濃度如下:
CH3OH(g),達到平衡后測得各組分的濃度如下:
物質 | CO | H2 | CH3OH |
濃度(mol·L-1) | 0.9 | 1.0 | 0.6 |
①反應達到平衡時,CO的轉化率為_______________。
②該反應的平衡常數K=________________。
③恒溫恒容條件下,可以說明反應已達到平衡狀態的是__________(填標號)。
A.v正(CO)=2v逆(H2) B.混合氣體的密度不變
C.混合氣體的平均相對分子質量不變 D.CH3OH、CO、H2的濃度都不再發生變化
④若將容器體積壓縮到1L,則達到新平衡時c(H2)的取值范圍是_____________。
⑤若保持容器體積不變,再充入0.6molCO和0.4molCH3OH,此時v正__________v逆(填“>”<”或“=”)。
(3)常溫下,HNO2的電離常數Ka=7.1×10-4mol·L-1,NH3·H2O的電離常數Kb=1.7×10-5mol·L-1。0.1mol·L-1NH4NO2溶液中離子濃度由大到小的順序是__________,常溫下NO2-水解反應的平衡常數Kb=__________(保留兩位有效數字)。
【答案】 2CO(g)+SO2(g)=S(s)+2CO2(g) △H=-270kJ·mol-1 40% ![]() L2·mol-2(或0.67L2·mol-2) CD 1mol·L-1<c(H2)<2mol·L-1 = c(NO2-)>c(NH4+)>c(H+)>c(OH-) 1.4×10-11
L2·mol-2(或0.67L2·mol-2) CD 1mol·L-1<c(H2)<2mol·L-1 = c(NO2-)>c(NH4+)>c(H+)>c(OH-) 1.4×10-11
【解析】(1)已知反應①C(s)+O2(g)=CO2(g) △H1=-393.5 kJ·mol-1
②CO2(g)+C(s)=2CO(g) △H2= + 172.5 kJ·mol-1
③S(s)+O2(g)=SO2(g) △H3=- 296.0 kJ·mol-1
根據蓋斯定律,由①-②-③得反應2CO(g)+SO2(g)=S(s)+2CO2(g) △H= △H1-△H2-△H3=-393.5 kJ·mol-1-172.5 kJ·mol-1-(- 296.0 kJ·mol-1)=-270kJ·mol-1;
(2) CO(g) + 2H2(g) ![]() CH3OH(g)
CH3OH(g)
起始濃度(mol/L)1.5 2.2 0
改變濃度(mol/L)0.6 1.2 0.6
平衡濃度(mol/L)0.9 1.0 0.6
①反應達到平衡時,CO的轉化率為![]() ×100%=40%;②該反應的平衡常數K=
×100%=40%;②該反應的平衡常數K=![]() =
=![]() =
=![]() L2·mol-2=0.67L2·mol-2);③A.根據化學反應速率之比等于計量數之比,有2v正(CO)= v正(H2),若2v正(CO)= v正(H2)= v逆(H2)則正逆反應速率相等,反應達到平衡狀態,但題給的是v正(CO)=2v逆(H2),選項A錯誤;B.反應在恒容條件下進行,反應物都為氣體,故氣體的總質量不變,容器的體積不變,密度始終保持不變,所以混合氣體的密度不變不能作為反應達到平衡的標志,選項B錯誤; C.根據“變量不變達平衡”該反應正反應為氣體體積縮小的反應,混合氣體的平均相對分子質量是變量,若不變了,證明反應已達平衡狀態,選項C正確;D.CH3OH、CO、H2的濃度都不再發生變化,反應物各濃度保持不變,說明反應已達平衡狀態,選項D正確。答案選CD;④CO(g)+2H2(g)
L2·mol-2=0.67L2·mol-2);③A.根據化學反應速率之比等于計量數之比,有2v正(CO)= v正(H2),若2v正(CO)= v正(H2)= v逆(H2)則正逆反應速率相等,反應達到平衡狀態,但題給的是v正(CO)=2v逆(H2),選項A錯誤;B.反應在恒容條件下進行,反應物都為氣體,故氣體的總質量不變,容器的體積不變,密度始終保持不變,所以混合氣體的密度不變不能作為反應達到平衡的標志,選項B錯誤; C.根據“變量不變達平衡”該反應正反應為氣體體積縮小的反應,混合氣體的平均相對分子質量是變量,若不變了,證明反應已達平衡狀態,選項C正確;D.CH3OH、CO、H2的濃度都不再發生變化,反應物各濃度保持不變,說明反應已達平衡狀態,選項D正確。答案選CD;④CO(g)+2H2(g)![]() CH3OH(g),若將容器體積壓縮為1L,各物質濃度應變為原來的2倍,但壓強增大,平衡向氣體體積減小的正反應方向移動,故氫氣的平衡濃度小于2mol/L,所以氫氣的平衡濃度應1mol/L<c(H2)<2mol/L;⑤若保持體積不變,再充入0.6molCO和0.4molCH3OH,則 各物質濃度為
CH3OH(g),若將容器體積壓縮為1L,各物質濃度應變為原來的2倍,但壓強增大,平衡向氣體體積減小的正反應方向移動,故氫氣的平衡濃度小于2mol/L,所以氫氣的平衡濃度應1mol/L<c(H2)<2mol/L;⑤若保持體積不變,再充入0.6molCO和0.4molCH3OH,則 各物質濃度為
CO(g) + 2H2(g) ![]() CH3OH(g)
CH3OH(g)
0.9+0.6=1.5 1.0 0.6+0.4=1
Q=![]() =
=![]() =K,說明反應達到的平衡和原來的平衡狀態相同,則V正=V逆;(3)常溫下,HNO2的電離常數Ka=7.1×10-4mol·L-1,NH3·H2O的電離常數Kb=1.7×10-5mol·L-1。Ka>Kb,NH4NO2溶液中銨根離子的水解大于亞硝酸根離子的水解,c(NO2-)>c(NH4+),溶液呈酸性,故0.1mol·L-1NH4NO2溶液中離子濃度由大到小的順序是c(NO2-)>c(NH4+)>c(H+)>c(OH-),NO2-水解的離子方程式為NO2-+H2O=HNO2+ OH-,常溫下NO2-水解反應的平衡常數Kb=
=K,說明反應達到的平衡和原來的平衡狀態相同,則V正=V逆;(3)常溫下,HNO2的電離常數Ka=7.1×10-4mol·L-1,NH3·H2O的電離常數Kb=1.7×10-5mol·L-1。Ka>Kb,NH4NO2溶液中銨根離子的水解大于亞硝酸根離子的水解,c(NO2-)>c(NH4+),溶液呈酸性,故0.1mol·L-1NH4NO2溶液中離子濃度由大到小的順序是c(NO2-)>c(NH4+)>c(H+)>c(OH-),NO2-水解的離子方程式為NO2-+H2O=HNO2+ OH-,常溫下NO2-水解反應的平衡常數Kb=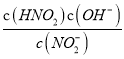 =
=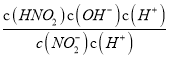 =
=![]() =
=![]() =1.4×10-11。
=1.4×10-11。


科目:高中化學 來源: 題型:
【題目】分子式為C7H8的某有機物,它能使酸性高錳酸鉀溶液褪色,但不能與溴水反應.在一定條件下與H2完全加成,加成后其一氯代物的同分異構體有( )
A.3種
B.4種
C.5種
D.6種
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】將4gNaOH和0.1mol Na2CO3混合并配成溶液,向溶液中滴加1.0molL﹣1稀鹽酸.下列圖像能正確表示加入鹽酸的體積和生成CO2的物質的量的關系的是( )
A.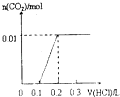
B.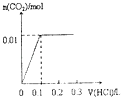
C.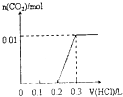
D.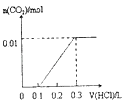
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】侯氏制堿法的原理為:NH3+CO2+H2O+NaCl═NaHCO3↓+NH4Cl,2NaHCO3 ![]() Na2CO3+H2O+CO2↑,實驗室模擬該過程包括制備NH3、制取NaHCO3、分離及灼燒NaHCO3四個步驟,下列圖示裝置能達到實驗目的是( )
Na2CO3+H2O+CO2↑,實驗室模擬該過程包括制備NH3、制取NaHCO3、分離及灼燒NaHCO3四個步驟,下列圖示裝置能達到實驗目的是( )
A. 制備氨氣
制備氨氣
B.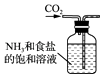 制取NaHCO3
制取NaHCO3
C.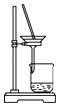 分離NaHCO3
分離NaHCO3
D. 灼燒NaHCO3
灼燒NaHCO3
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】實驗室欲快速制取H2,應選用正確的措施是
A.純鋅與稀硫酸反應B.將浸泡過CuS04溶液的Zn跟稀硫酸反應
C.粗鋅跟硝酸反應D.粗鋅跟濃硫酸反應
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】下列有關計算的分析正確的是
A. 某溶液100 mL,其中含硫酸0.03 mol,硝酸0.04 mol,若在該溶液中投入1.92 g銅粉微熱,反應后放出一氧化氮氣體約為0.015 mol
B. 室溫時,在容積為a mL的試管中充滿NO2氣體,然后倒置在水中到管內水面不再上升時為止;再通入b mL O2,則管內液面又繼續上升,測得試管內最后剩余氣體為c mL,且該氣體不能支持燃燒,則a、b的關系是a=4b+c
C. 反應KClO4+8HCl===KCl+4Cl2↑+4H2O中,每生成4 mol Cl2轉移的電子數為8NA
D. 磁性氧化鐵與過量稀硝酸反應的化學方程式為:Fe3O4+HNO3(稀) ![]() Fe(NO3)3+NO↑+H2O(未配平)23.2 g磁性氧化鐵完全溶解于稀硝酸中,轉移0.1 mol電子
Fe(NO3)3+NO↑+H2O(未配平)23.2 g磁性氧化鐵完全溶解于稀硝酸中,轉移0.1 mol電子
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】有下列物質: ①蛋白質 ②脂類 ③糖類 ④無機鹽 ⑤維生素 ⑥水.
其中屬于人體需要的營養素有( )
A.①②③
B.①②③④
C.①②③④⑤
D.全部
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】氯氣是一種重要的工業原料。工業上利用反應在3Cl2+2NH3=N2+6HCl檢查氯氣管道是否漏氣。下列說法錯誤的是( )
A.若管道漏氣遇氨就會產生白煙B.該反應利用了Cl2的強氧化性
C.該反應屬于復分解反應D.生成1molN2有6mol電子轉移
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】鉍是一種綠色稀有金屬,鉍及其化合物在工業生產中用途廣泛,工業上常采用粗鉍精煉制得用途更為廣泛的精煉鉍(含鉍99.995%),火法精煉鉍的工藝流程如下:

已知:①粗鉍(鉛鉍合金)的主要化學成分如下表:
元素 | Ag | Bi | Pb | As | Sb |
含量/% | 0.90 | 55.25 | 27 | 1.30 | 11 |
②氯化鉛熔點為498℃,密度為5.9g/cm3;鉍的熔點為271℃,沸點為1470℃;BiCl3的熔點為506.5℃。
③鋅酸鹽簡寫成ZnO22-,如鋅酸鈉Na2ZnO2。
④+3價鉍的化合物較為穩定,鉍酸鈉難溶于水。
回答下列問題:
(1)實驗室中升溫熔化粗鉍一般用酒精噴燈在________(填主要儀器名稱)中完成。
(2)NaBiO3中鉍元素的化合價為________。
(3)“氧化除砷銻”的工藝機理是粗鉍熔融液在680~750℃的條件下,鼓入壓縮空氣,使砷、銻氧化揮發,同時空氣也與鉍液反應,利用Bi2O3的_______性將雜質砷、銻轉變成As2O3、Sb2O3而除去。
(4)“氯化除鉛”過程中,氯氣與鉛、鉍反應分別生成PbCl2、BiCl3,生成的BiCl3又會被鉛還原,發生反應3Pb+2BiCl3=3PbC12+2Bi,控制溫度350-400℃,利用熔點和密度特點,氯化鉛上浮至鉍液表面呈_______態覆蓋,防止氯氣__________________。
(5)高溫精煉的實質為堿性精煉,加入少量KNO3和NaOH,將鋅氧化成鋅酸鹽而除去殘鋅,同時得到氮氣,寫出高溫精煉的化學方程式: __________________。
(6)向含有MnSO4的酸性溶液中加入鉍酸鈉粉末,溶液變為紫紅色,該反應經常用來檢驗Mn2+,寫出該反應的離子方程式__________________。
查看答案和解析>>
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com