
分析 有A、B、C、D四種化合物,分別由NH4+、Ba2+、SO42-、HCO3-、OH-中的兩種組成,它們具有下列性質:
①A不溶于水和鹽酸,說明是A是BaSO4沉淀;
②B不溶于水,但溶于鹽酸,說明B沉淀為BaSO3;
③C溶于水,溶液呈堿性,與H2SO4反應生成A是BaSO4沉淀,證明C為Ba(OH)2;
④D的溶液和C的溶液混合加熱既有沉淀又有氣體生成,說明是銨鹽,而且生成沉淀溶于鹽酸,產生無色無味的氣體,說明沉淀為BaCO3,則D為NH4HCO3 .
解答 解:有A、B、C、D四種化合物,分別由NH4+、Ba2+、SO42-、HCO3-、OH-中的兩種組成,它們具有下列性質:
①A不溶于水和鹽酸,說明是A是BaSO4沉淀;
②B不溶于水,但溶于鹽酸,說明B沉淀為BaSO3;
③C溶于水,溶液呈堿性,與H2SO4反應生成A是BaSO4沉淀,證明C為Ba(OH)2;
④D的溶液和C的溶液混合加熱既有沉淀又有氣體生成,說明是銨鹽,而且生成沉淀溶于鹽酸,產生無色無味的氣體,說明沉淀為BaCO3,則D為NH4HCO3 ;
推斷得到A為BaSO4,B為BaSO3,C為Ba(OH)2,D為NH4HCO3 ,
(1)上述推斷可知A為BaSO4,D為NH4HCO3 ,
故答案為:BaSO4,NH4HCO3 ,
(2)①B為BaSO3與鹽酸反應生成氯化鋇、二氧化碳和水,反應的離子方程式為:BaSO3+2H+=Ba2++H2O+CO2↑,
故答案為:BaSO3+2H+=Ba2++H2O+CO2↑;
②D與過量的C溶液混合加熱生成碳酸鋇,氨氣和水,碳酸氫銨全部反應,反應的離子方程式為:NH4 ++HCO3-+Ba2++2OH-=BaCO3↓+2H2O+NH3↑,
故答案為:NH4 ++HCO3-+Ba2++2OH-=BaCO3↓+2H2O+NH3↑.
點評 本題考查了物質推斷,為高頻考點,側重于學生的分析能力和實驗能力的考查,注意把你我物質性質和反應現象的分析判斷,物質檢驗實驗方法分析,實驗過程中反應現象的理解應用,物質和離子性質熟練掌握是解題關鍵,題目難度中等.


 閱讀快車系列答案
閱讀快車系列答案科目:高中化學 來源: 題型:解答題
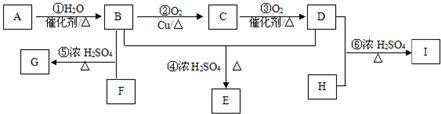
 .
.查看答案和解析>>
科目:高中化學 來源: 題型:解答題
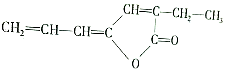 ,該物質在現代工業合成中大有用途,請回答下列有關該物質的問題:
,該物質在現代工業合成中大有用途,請回答下列有關該物質的問題:查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
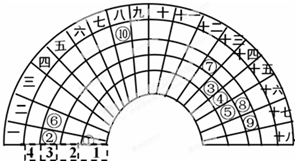 元素周期表的形式多種多樣,如圖是扇形元素周期表的一部分(1~36號元素),對比中學常見元素周期表思考扇形元素周期表的填充規律,下列說法不正確的是( )
元素周期表的形式多種多樣,如圖是扇形元素周期表的一部分(1~36號元素),對比中學常見元素周期表思考扇形元素周期表的填充規律,下列說法不正確的是( )| A. | ⑥、⑧、⑨對應原子的半徑依次減小 | |
| B. | ②、⑦的最高價氧化物對應的水化物能相互反應 | |
| C. | 元素⑩處于常見周期表第四周期第VIIIB族 | |
| D. | ①分別與③、④、⑤形成的氣態化合物穩定性大小為:⑤>④>③ |
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| A. | NaClO是“84消毒液”的有效成分,其水溶液能使有色布條褪色,反應中NaClO表現還原性 | |
| B. | Cl2與燒堿溶液反應的實質是Cl2+OH-═Cl-+ClO-+H2O | |
| C. | 氯氣有毒,在通風櫥中制備氯氣可以消除氯氣的污染 | |
| D. | 將Cl2通入淀粉-KI溶液,溶液變藍色 |
查看答案和解析>>
科目:高中化學 來源: 題型:解答題
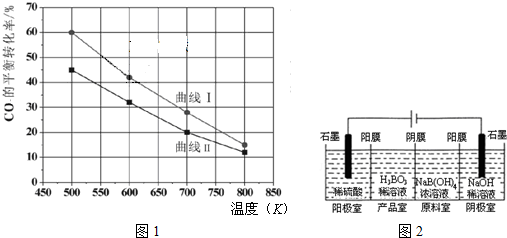
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| 序號 | A | B | C | D |
| 物質類型 | 離子化合物 | 共價鍵直接構成的物質 | 共價分子 | 稀有氣體 |
| 代表物質 | NaCl | 金剛石 | 干冰 | Ne |
| 組成晶體的結構微粒 | Na+、Cl- | C | CO2 | Ne |
| 結構微粒間相互作用 | 離子鍵 | 共價鍵 | 分子間作用力 | 共價鍵 |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| A. | $\frac{16n}{3m-2n}$ | B. | $\frac{32n}{n-m}$ | C. | $\frac{32m}{3n-2m}$ | D. | $\frac{32n}{3n-2m}$ |
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| A. | 2、64、24 | B. | 64、2、24 | C. | 64、24、2 | D. | 16、2、24 |
查看答案和解析>>
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com