
【題目】1892年比利時人索爾維以NaCl、CO2、NH3、H2O為原料制得了純凈的Na2CO3,該法又稱氨堿法,其主要生產流程如下。完成下列填空
(1) 寫出反應①中產生碳酸氫鈉的離子方程式_________________________________。
(2)NaHCO3在水中溶解度較小,以沉淀形式析出,則圖中③的操作名稱___________________。從綠色化學原料的充分利用的角度看,該方法有明顯的缺陷(答一條即可)___________。
【答案】Na++NH3+CO2+H2O→NaHCO3↓+NH4+ 過濾 產物CaCl2沒有利用上
【解析】
工業制堿的原理涉及反應:![]() ,
,![]() ,索爾維法用生成的氯化銨制備氨氣,將氯化銨進行了循環利用,所以從理論上講,是不需要補充氨的,但是在生產過程中,
,索爾維法用生成的氯化銨制備氨氣,將氯化銨進行了循環利用,所以從理論上講,是不需要補充氨的,但是在生產過程中,![]() 母液被棄去,氯化銨制備氨氣生成了無用的氯化鈣,這兩點是索爾維法的缺陷。
母液被棄去,氯化銨制備氨氣生成了無用的氯化鈣,這兩點是索爾維法的缺陷。
(1)根據流程圖,反應①是向飽和氯化鈉溶液中通入氨氣和二氧化碳,離子方程式為:![]() ,
,
答案為:![]() ;
;
(2)![]() 在水中溶解度較小,以沉淀形式析出,故③操作為過濾,從綠色化學原料的充分利用的角度看,
在水中溶解度較小,以沉淀形式析出,故③操作為過濾,從綠色化學原料的充分利用的角度看,![]() 母液被棄去,氯化銨制備氨氣生成了無用的氯化鈣,這兩點是索爾維法的缺陷,
母液被棄去,氯化銨制備氨氣生成了無用的氯化鈣,這兩點是索爾維法的缺陷,
答案為:過濾;產物![]() 沒有利用上
沒有利用上


 名校課堂系列答案
名校課堂系列答案科目:高中化學 來源: 題型:
【題目】已知表中是某些有機物的模型圖,根據要求回答下列問題:
有機物 | 甲 | 乙 | 丙 |
模型 |
|
|
|
(1)甲的分子式是___________________,其一氯代物有___________________種。
(2)寫出乙與![]() 的
的![]() 溶液發生反應的化學方程式:______________________________________,該反應的反應類型是___________________。
溶液發生反應的化學方程式:______________________________________,該反應的反應類型是___________________。
(3)丙的摩爾質量為![]() ,則用苯制備該物質時的催化劑是___________________。
,則用苯制備該物質時的催化劑是___________________。
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】2014年中國十大科技成果之一是:我國科學家成功實現甲烷在催化劑及無氧條件下,一步高效生產乙烯、芳烴和氫氣等化學品,為天然氣化工開發了一條革命性技術。以甲烷為原料合成部分化工產品流程如圖(部分反應條件已略去):
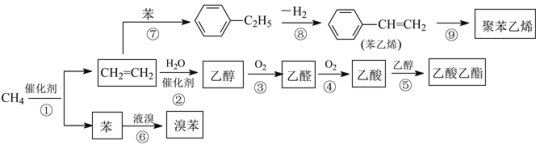
(1)乙酸分子中所含官能團名稱為_____。
(2)聚苯乙烯的結構簡式為_____。
(3)圖中9步反應中只有兩步屬于取代反應,它們是_____(填序號)。
(4)寫出下列反應的化學方程式(注明反應條件):
反應⑤為_____;
反應⑥為______。
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】![]() 時,將
時,將![]() 溶液逐滴滴加到
溶液逐滴滴加到![]() 溶液中,所得溶液的
溶液中,所得溶液的![]() 與滴加
與滴加![]() 的體積關系如右圖所示。下列指定溶液濃度關系說法正確的是
的體積關系如右圖所示。下列指定溶液濃度關系說法正確的是
已知:![]() ,
,![]() 時
時![]() 的
的![]() ,
,![]() 。
。
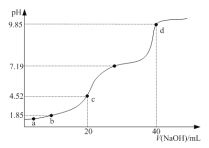
A.![]() 點所得溶液中:
點所得溶液中:![]()
B.![]() 點所得溶液中:
點所得溶液中:![]()
C.![]() 點所得溶液中:
點所得溶液中: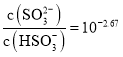
D.![]() 點所得溶液中:
點所得溶液中:![]()
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】A、B、C、D、E、F為中學化學中的常見物質,且物質A由1~2種短周期元素組成,在一定條件下有如圖轉化關系,請完成下列問題:
![]()
(1)若常溫下A為有色氣體。
①當F是一種金屬單質時,請寫出一定濃度的B溶液和適量F反應生成C與氣體E的離子方程式:_________________。
②當C為直線形分子時,E具有漂白性,物質F焰色反應呈黃色,則C的電子式為________________;D中所含化學鍵的類型為____________________。
(2)若A為淡黃色固體,D為白色難溶于水的物質,且A和D的相對分子質量相等,請用離子方程式表示F的水溶液呈酸性的原因:_________________。
(3)若A中一種元素原子的最外層電子數為內層電子總數的![]() ,將B和D分別溶于水,所得溶液按恰當比例混合,可得一種不含金屬元素的鹽溶液,請寫出A與H2O反應的化學方程式:____________;B轉化為C的化學方程式為______________。
,將B和D分別溶于水,所得溶液按恰當比例混合,可得一種不含金屬元素的鹽溶液,請寫出A與H2O反應的化學方程式:____________;B轉化為C的化學方程式為______________。
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】我國化學家侯德榜改革國外的純堿生產工藝,創造了侯德榜制堿法又叫聯堿法,該法是將合成氨工廠生產的NH3及副產品CO2,再與飽和食鹽水反應.
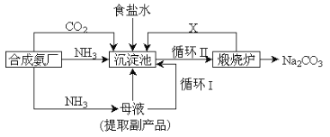
(1)該法與氨堿法比大大提高了原料利用率,主要表現在_______。
(2)碳酸氫鈉分解產生的二氧化碳可循環使用,但必須要補充,補充的主要原因是_________,但實際生產中補充量超過理論上反應耗用量,可能的原因是______。
(3)氨堿法需補充的二氧化碳一定來自_________。那么聯合制堿需補充的二氧化碳可能來自__________。
(4)侯德榜法在濾去碳酸氫鈉的母液中通氨氣并加入細小食鹽顆粒,冷卻析出副產品,通氨氣的作用____。
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】已知:①A的產量通常用來衡量一個國家的石油化工水平;
②![]() 。
。
現以A為主要原料合成化合物E,其合成路線如圖所示。回答下列問題:
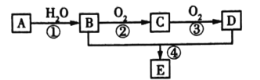
(1)寫出下列物質的官能團名稱:B_____;C______。
(2)反應④的化學方程式為_____________,反應類型是__________。
(3)某學習小組設計B的催化氧化的實驗裝置如圖所示,試回答下列問題。
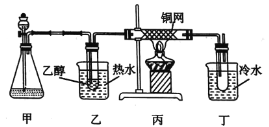
①甲的錐形瓶中盛放的固體藥品可能為_______(填字母)。
A.![]() B.
B.![]() C.
C.![]() D.
D.![]()
②實驗過程中,丙裝置硬質玻璃管中發生反應的化學方程式為_____________。
③物質B的催化氧化產物與葡萄糖具有相同的特征反應,將所得的氧化產物與新制氫氧化銅懸濁液混合后加熱,現象為___________。
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】I.寫出下列反應的熱化學方程式。
(1)CuCl(s)與O2反應生成CuCl2(s)和一種黑色固體。在25 ℃、101 kPa下,已知該反應每消耗1 mol CuCl(s),放熱44.4 kJ,該反應的熱化學方程式是_____________________。
(2)在1.01×105 Pa時,16 g S固體在足量的氧氣中充分燃燒生成二氧化硫,放出148.5 kJ的熱量,則S固體燃燒熱的熱化學方程式為________________________。
II.研究NOx、SO2、CO等大氣污染氣體的處理具有重要意義。
(3)處理含CO、SO2煙道氣污染的一種方法是將其在催化劑作用下轉化為單質S固體。已知:
①CO(g)+![]() O2(g)=CO2(g) ΔH=-283.0 kJ·mol-1
O2(g)=CO2(g) ΔH=-283.0 kJ·mol-1
②S(s)+O2(g)=SO2(g) ΔH=-296.0 kJ·mol-1
此反應的熱化學方程式是_____________________。
(4)氮氧化物是造成光化學煙霧和臭氧層損耗的主要氣體。已知:
CO(g)+NO2(g)=NO(g)+CO2(g) ΔH=-a kJ·mol-1(a>0)
2CO(g)+2NO(g)=N2(g)+2CO2(g) ΔH=-b kJ·mol-1(b>0)
若用標準狀況下3.36 L CO還原NO2至N2(CO完全反應)的整個過程中轉移電子的物質的量為________mol,放出的熱量為______________kJ(用含有a和b的代數式表示)。
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】如圖是恒溫下某化學反應的反應速率隨反應時間變化的示意圖。下列敘述與示意圖不相符合的是
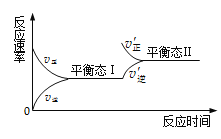
A.反應達平衡時,正反應速率和逆反應速率相等
B.該反應達到平衡Ⅰ后,增大反應物的濃度,平衡發生移動,達到平衡態Ⅱ
C.該反應達到平衡態Ⅰ后,減小反應物濃度,平衡發生移動,達到平衡態Ⅱ
D.同一種氣體反應物在平衡態Ⅰ和平衡態Ⅱ時體積分數不相等
查看答案和解析>>
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com