
【題目】在2 L恒容密閉容器中,800 ℃時反應2NO(g)+O2(g)2NO2(g)體系中,n(NO)隨時間的變化如下表:
時間(s) | 0 | 1 | 2 | 3 | 4 | 5 |
n(NO)(mol) | 0.020 | 0.010 | 0.008 | 0.007 | 0.007 | 0.007 |
(1)圖中表示NO2的變化的曲線是________。
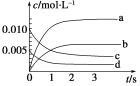
(2)能說明該反應已經達到平衡狀態的是________。
a.v(NO2)=2v(O2)
b.容器內壓強保持不變
c.v(NO)逆=2v(O2)正
d.容器內的密度保持不變
(3)能夠使該反應的反應速率增大,且平衡向正反應方向移動的是________。
a.及時分離出NO2氣體
b.增大O2的濃度
【答案】bb、cb
【解析】
(1)根據n(NO)隨時間的變化可知3 s時反應達到平衡,NO的物質的量減少0.020 mol-0.007 mol=0.013 mol,濃度減小了0.013/2=0.0065 mol·L-1,所以NO2的物質的量濃度由0增加到0.0065 mol·L-1,故b曲線正確;綜上所述,本題答案是:b。
(2)a項,未指明反應進行的方向,不能判定反應是否達到平衡狀態,錯誤;
b項,因該反應前后有氣體體積的變化,即未達到平衡時,壓強一直在變化,容器內壓強保持不變,反應達到平衡狀態,正確;
c項,用v(NO)、v(O2)表示時,方向相反,大小關系符合化學計量數之比,可以判斷反應達到平衡狀態,正確;
d項,根據密度ρ=m/V,因反應前后m(氣)守恒,V(容)不變,故密度始終不變,無法判斷反應達到平衡狀態,錯誤;
符合題意的選項只有b、c;綜上所述,本題選b、c。
(3)a項,及時分離出NO2氣體,減小生成物濃度,平衡右移,反應速率減慢,不合題意,錯誤;
b項,增大O2的濃度,反應速率增大,平衡向正反應方向移動,符合題意,正確;
綜上所述,本題選b。


 開心試卷期末沖刺100分系列答案
開心試卷期末沖刺100分系列答案 雙基同步導航訓練系列答案
雙基同步導航訓練系列答案 黃岡小狀元同步計算天天練系列答案
黃岡小狀元同步計算天天練系列答案科目:高中化學 來源: 題型:
【題目】25 ℃時,pH=7的(NH4)2SO4與NH3·H2O的混合溶液中,c(NH4+)與c(SO42-)之比是
A.小于2∶1B.大于2∶1C.等于2∶1D.無法判斷
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】設阿伏加德羅常數的數值為NA,下列說法正確的是
A. pH=3的硫酸溶液中所含H+的數目為10-3NA
B. 7.8g Na2O2與足量SO2完全反應,轉移的電子數為0. 1NA
C. 標準狀況下,11.2 L丙烷中含有的共用電子對數目為5NA
D. 0.1mol NH3與0.1 mol HC1在密閉容器中充分反應后,氣體的分子總數為0.1NA
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】I、煤制天然氣的工藝流程簡圖如下:

⑴反應I:C(s) + H2O(g)![]() CO(g) + H2(g) ΔH = +135 kJ·mol-1,通入的氧氣會與部分碳發生燃燒反應。請利用能量轉化及平衡移動原理說明通入氧氣的作用:___________________________。
CO(g) + H2(g) ΔH = +135 kJ·mol-1,通入的氧氣會與部分碳發生燃燒反應。請利用能量轉化及平衡移動原理說明通入氧氣的作用:___________________________。
⑵反應II:CO(g) + H2O(g) ![]() CO2(g) + H2(g) ΔH = 41 kJ·mol-1。如圖表示不同溫度條件下,煤氣化反應I發生后的汽氣比(水蒸氣與CO物質的量之比)與CO平衡轉化率的變化關系。
CO2(g) + H2(g) ΔH = 41 kJ·mol-1。如圖表示不同溫度條件下,煤氣化反應I發生后的汽氣比(水蒸氣與CO物質的量之比)與CO平衡轉化率的變化關系。

① 判斷T1、T2和T3的大小關系:______________。(從小到大的順序)
② 若煤氣化反應I發生后的汽氣比為0.8,經煤氣化反應I和水氣變換反應II后,得到CO與H2的物質的量之比為1:3,則反應II應選擇的溫度是_______(填“T1”或“T2”或“T3”)。
⑶① 甲烷化反應IV發生之前需要進行脫酸反應III。煤經反應I和II后的氣體中含有兩種酸性氣體,分別是H2S和_______。
② 工業上常用熱碳酸鉀溶液脫除H2S氣體得到兩種酸式鹽,該反應的離子方程式是_______。
II、利用甲烷超干重整CO2技術可得到富含CO的氣體,將甲烷和二氧化碳轉化為可利用的化學品,其能源和環境上的雙重意義重大。該技術中的化學反應為:
CH4 (g)+3CO2 (g)![]() 2H2O(g)+4CO(g)
2H2O(g)+4CO(g) ![]() H>0
H>0
CH4超干重整CO2的催化轉化原理示意如圖:

⑷過程II,實現了含氫物種與含碳物種的分離。生成H2O(g)的化學方程式是______________。
⑸假設過程I和過程II中的各步均轉化完全,下列說法正確的是_______。((填序號)
a.過程I和過程II中均含有氧化還原反應
b.過程II中使用的催化劑為Fe3O4 和CaCO3
c.若過程I投料![]() ,可導致過程II中催化劑失效
,可導致過程II中催化劑失效
(6)一定條件下,向體積為2L的恒容密閉容器中充入1.2 mol CH4(g)和4.8 mol CO2(g),發生反應CH4 (g)+3CO2 (g)![]() 2H2O(g)+4CO(g)
2H2O(g)+4CO(g) ![]() H>0,實驗測得,反應吸收的能量和甲烷的體積分數隨時間變化的曲線圖像如圖。計算該條件下,此反應的
H>0,實驗測得,反應吸收的能量和甲烷的體積分數隨時間變化的曲線圖像如圖。計算該條件下,此反應的![]() H=________________。
H=________________。

查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】向2.0 L恒容密閉容器中充入1.0 mol PCl5,在溫度為T℃時發生如下反應PCl5(g) ![]() PCl3(g)+C12(g) ΔH=+124 kJ·mol-1。反應過程中測定的部分數據見下表:
PCl3(g)+C12(g) ΔH=+124 kJ·mol-1。反應過程中測定的部分數據見下表:
時間t/s | 0 | 50 | 150 | 250 | 350 |
n(PCl3)/mol | 0 | 0.16 | 0.19 | 0.2 | 0.2 |
回答下列問題:
(1)反應在前50 s的平均速率v(PCl5) =______________;
(2)溫度為T℃時,該反應的化學平衡常數=________;
(3)要提高上述反應的轉化率,可采取的措施是________ (任寫一種) ;
(4)在溫度為T℃時,若起始時充入0.5 mol PCl5和a mol Cl2,平衡時PCl5的轉化率仍為20%,則a=________。
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】LiAlH4是重要的儲氫材料,其組成類似于Na3AlF6。常見的供氫原理如下面兩個方程式所示:①2LiAlH4![]() 2LiH+2Al+3H2↑,②LiAlH4+2H2O=LiAlO2+4H2↑。下列說法正確的是
2LiH+2Al+3H2↑,②LiAlH4+2H2O=LiAlO2+4H2↑。下列說法正確的是
A. 若反應①中生成3.36L氫氣,則一定有2.7g鋁生成
B. 氫化鋰也是一種儲氫材料,供氫原理為LiH+H2O=LiOH+H2↑
C. 生成等質量的氫氣,反應①②轉移電子數之比為4:3
D. LiAlH4是共價化合物,LiH是離子化合物
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】已知可逆反應X(g)+2Y(g)![]() Z(g) ΔH <0,一定溫度下,在體積為2 L的密閉容器中加入4 mol Y和一定量的X后,X的濃度隨時間的變化情況如圖所示,則下列說法正確的是( )
Z(g) ΔH <0,一定溫度下,在體積為2 L的密閉容器中加入4 mol Y和一定量的X后,X的濃度隨時間的變化情況如圖所示,則下列說法正確的是( )

A. 若向該容器中加入1molX、2molY,達平衡時,X的平衡濃度小于0.125mol/L
B. a點正反應速率大于逆反應速率
C. 反應達平衡時,降低溫度可以實現c到d的轉化
D. 該條件下,反應達平衡時,平衡常數K=3
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】氨氣在工業上有廣泛用途。請回答以下問題:
(1)工業上利用N2(g)+3H2(g) ![]() 2NH3(g) H<0合成氨,某小組為了探究外界條件對該反應的影響,以c0 mol/L H2參加合成氨反應,在a、b兩種條件下分別達到平衡,如圖。
2NH3(g) H<0合成氨,某小組為了探究外界條件對該反應的影響,以c0 mol/L H2參加合成氨反應,在a、b兩種條件下分別達到平衡,如圖。

①相對a而言,b可能改變的條件是____________,判斷的理由是__________________;
②a條件下,0~t0的平均反應速率v(N2)=_____________mol·L-1·min-1;
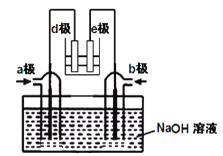
(2)有人利用NH3和NO2構成電池的方法,既能實現有效消除氮氧化物的排放減少環境污染,又能充分利用化學能進行粗鋁的精煉,如圖B所示,e極為精鋁。
a極通入____氣體(填化學式),判斷的理由是___________________________________;
(3)某小組往一恒溫恒壓容器充入9mol N2和23mol H2模擬合成氨反應,如圖為不同溫度下平衡混合物中氨氣的體積分數與總壓強(p)的關系圖。若體系在T2、60MPa下達到平衡。
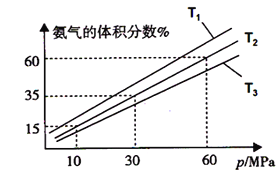
①能判斷N2(g)+3H2(g) ![]() 2NH3(g)達到平衡的是______(填序號) ;
2NH3(g)達到平衡的是______(填序號) ;
a.容器內壓強不再發生變化 b.混合氣體的密度不再發生變化
c.v正(N2)=3v逆(H2) d.混合氣體的平均相對分子質量不再發生變化
②若T1、T2、T3溫度下的平衡常數分別為K1、K2、K3,則K1、K2、K3由大到小的排序為_______________,
③此時N2的平衡分壓為__________Mpa,(分壓=總壓×物質的量分數)
計算出此時的平衡常數Kp=________。(用平衡分壓代替平衡濃度計算,結果保留2位有效數字并帶上單位)
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】下列五種有機物中:A.CH4;B.CH2=CH2;C.CH3CH2OH;D.CH3COOH;E.淀粉。
(1)C分子中含有的官能團的名稱是_____;
(2)A分子的結構式是_____;
(3)水溶液顯酸性的是_____(填編號);
(4)可用于合成聚乙烯塑料的是_____(填編號),化學反應方程式為_____________________ ;
(5)通常用于檢驗碘單質的是_____(填編號)。
查看答案和解析>>
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com