
【題目】甲裝置中所含的是物質的量之比為1:2的CuSO4和NaCl的混合溶液,電解過程中溶液的pH值隨時間t變化的示意圖如乙示(不考慮電解產物可能與水的反應)。試分析下列敘述中正確的是( )
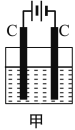
A.是該混合溶液中的SO42-導致了A點溶液的pH值小于B點
B.AB線段與BC線段在陰極上發生的反應是相同的,即:Cu2+ + 2e=Cu
C.BC段陰極產物和陽極產物的體積之比為2:1
D.在整個電解的過程中會出現少量淡藍色的Cu(OH)2沉淀
【答案】C
【解析】
假設溶液中n(CuSO4)=1mol、n(NaCl)=2mol,電解初始,陽極上氯離子放電、陰極上銅離子放電,當轉移2mol電子時,陰極上銅離子完全放電生成Cu、陽極上氯離子完全放電生成氯氣,溶液中的溶質之間變為硫酸鈉,當銅離子、氯離子完全放電后,繼續電解,實際上是電解水,溶液的pH不變,據以上分析解答。
A. 硫酸銅是強酸弱堿鹽,銅離子水解導致溶液呈酸性,B點銅離子和氯離子完全放電,溶液中的溶質為強酸強堿鹽硫酸鈉,所以A點pH小于B點,A項錯誤;
B. AB段是電解CuCl2,BC段是電解H2O,AB段陰極電極反應式為Cu2++2e-=Cu,BC段陰極電極反應式為2H++2e-=H2↑,B項錯誤;
C. BC段是電解水,陰極上生成氫氣、陽極上生成氧氣,所以陰極產物和陽極產物的體積之比為2:1,C項正確;
D. 整個電解過程中溶液不呈堿性,所以不會出現氫氧化銅藍色沉淀,D項錯誤;
答案選C。


科目:高中化學 來源: 題型:
【題目】若NA表示阿伏加德羅常數,則下列說法不正確的是
A. 23g 鈉在空氣中充分燃燒,轉移的電子數為NA
B. 50ml 12mol/L的鹽酸與足量的MnO2共熱,充分反應后,轉移電子數為0.3NA
C. 0.6mol過氧化鈉晶體中所含陰離子的數目為0.6NA
D. 常溫常壓下,8.8gN2O 和CO2混合氣體所含的原子總數為0.6NA
查看答案和解析>>
科目:高中化學 來源: 題型:
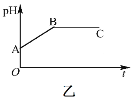
【題目】“麻黃素”是中樞神經興奮劑,其合成路線如圖所示:
已知:CH3C![]() CH+H2O
CH+H2O![]()
(1)F中的官能團的名稱為__。
(2)B→C的反應條件是__,反應類型是__,E的結構簡式為__。
(3)寫出C→D的化學反應方程式__。
(4)麻黃素的分子式為__。
(5)H是G的同系物,也含醇羥基和碳氮雙鍵,相對分子質量比G小28,且苯環上僅有一個側鏈,則H的可能結構有___種(不考慮![]() 結構)。
結構)。
(6)已知:R-C![]() C-R
C-R![]() R-CH=CH-R,請仿照題中流程圖合成路線,設計以乙醇為起始主原料合成強吸水性樹脂
R-CH=CH-R,請仿照題中流程圖合成路線,設計以乙醇為起始主原料合成強吸水性樹脂![]() 的合成路線,其它試劑及溶劑任選__。
的合成路線,其它試劑及溶劑任選__。
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】新型鈣鈦礦太陽能電池具備更加清潔、便于應用、制造成本低和效率高等顯著優點。 一種鈣鈦礦太陽能電池材料的晶胞如圖所示。
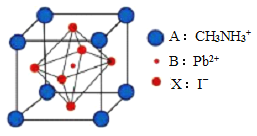
請按要求回答下列有關問題:
(1)構成 CH3NH3 的三種元素中電負性最小的是_____________; 寫出碳原子的電子排布式為__________。
(2)Pb 與 C 同主族,比 C 的周期序數大 4,寫出 Pb 原子最外層電子的軌道表示式(即電子排布圖)__________________。
(3)有關 NH3 的結構與性質探究
① NH3 分子中所含化學鍵是____________(從“極性鍵”、“非極性鍵”、“配位鍵”、 “離子鍵”、“σ鍵”或“ π鍵”中選填符合的名稱);N 原子的雜化形式為__________。
② NH3 分子的 VSEPR 模型名稱為_________,分子的空間結構(即立體構型) 為______。
③如圖所示,探究 NH3 的性質時,打開止水夾,擠壓膠頭滴管,可以觀察到燒瓶中迅速產生紅色噴泉。請用必要的分子結構 與性質的知識和化學用語解釋產生該現象的原因:_________、________。
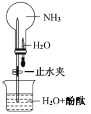
(4)該鈣鈦礦太陽能電池材料的化學式為________________;該晶胞中,與 I- 緊鄰的 I- 個數為_____________; 測定其晶體結構特征最可靠的方法是____________實驗。
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】在一恒容的密閉容器中充入0.1mol/LCO2、0.1mol/LCH4,在一定條件下發生反應CH4(g)+CO2(g)![]() 2CO(g)+2H2(g),測得CH4平衡時轉化率與溫度、壓強的關系如圖,下列有關說法不正確的是( )
2CO(g)+2H2(g),測得CH4平衡時轉化率與溫度、壓強的關系如圖,下列有關說法不正確的是( )
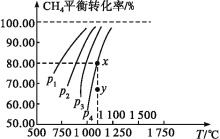
A.上述反應的ΔH>0
B.壓強:p4>p3>p2>p1
C.1100℃時該反應平衡常數約為1.64
D.壓強為p4時,在y點:v(正)<v(逆)
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】有X、Y、Z、M、G五種元素,是分屬三個短周期并且原子序數依次增大的主族元素。其中X、Z同主族,可形成離子化合物ZX;Y、M同主族,可形成MY2、MY3兩種分子。在熔融狀態下,將Z的單質和FeG2(元素G和鐵構成的某化合物)組成一個可充電電池(裝置示意圖如下),反應原理為:2Z +FeG2![]() Fe+2ZG
Fe+2ZG
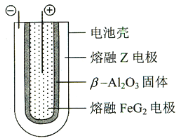
放電時,電池的正極反應式為:______________;充電時,接電源負極的電極材料是____(寫物質名稱),該電池的電解質為_______(填寫化學式)。
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】氨氣是中學化學中常見的氣體,其用途廣泛。
(1)工業上氨氣可以由氫氣和氮氣合成。
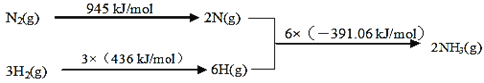
①該反應的熱化學方程式是___。
②450℃,將5molN2和5molH2充入2L恒容密閉容器中發生反應,5min后達到平衡,N2的轉化率為20%,則NH3的化學反應速率v(NH3)=___,該溫度下如圖所示反應的平衡常數的數值K=___,溫度升高,平衡常數K將___(填“增大”、“減小”或“不變”)。
(2)工業制硫酸的尾氣中含較多的SO2,為防止污染空氣,回收利用SO2,工業上常用氨水吸收法處理尾氣。
①當氨水中所含氨的物質的量為3mol,吸收標準狀況下44.8LSO2時,溶液中的溶質為___。
②已知NH4HSO3溶液顯酸性。用氨水吸收SO2,當吸收液顯中性時,溶液中離子濃度關系正確的是___。
A.c(NH4+)=2c(SO32-)+c(HSO3-)
B.c(NH4+)>c(SO32-)>c(H+)=c(OH-)
C.c(NH4+)+c(H+)=c(SO32-)+c(HSO3-)+c(OH-)
D.c(NH4+)+c(NH3·H2O)=c(SO32-)+c(HSO3-)+c(H2SO3)
(3)氨氣是一種富氫燃料,可以直接用于燃料電池,如圖是供氨水式燃料電池工作原理:
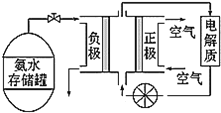
①氨氣燃料電池的電解質溶液最好選擇___(填“酸性”、“堿性”或“中性”)溶液。
②氨氣燃料電池的反應是氨氣與氧氣生成一種常見的無毒氣體和水,該電池的總反應方程式為___,正極的電極反應式為___。
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】已知:①Sn(s、白)+2HCl(aq)=SnCl2(aq)+H2(g) ΔH1
②Sn(s、灰)+2HCl(aq)=SnCl2(aq)+H2(g) ΔH2
③Sn(s、灰)![]() Sn(s、白) ΔH3=+2.1kJ/mol,下列說法不正確的是( )
Sn(s、白) ΔH3=+2.1kJ/mol,下列說法不正確的是( )
A.灰錫與白錫互為同素異形體
B.錫在常溫下以白錫狀態存在
C.白錫轉化為灰錫的反應是放熱反應
D.ΔH1﹥ΔH2
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】標準狀況下15 g CO與CO2的混合氣體,體積為11.2 L。則:
(1)混合氣體的密度是_________。
(2)混合氣體的平均摩爾質量是_________。
(3)CO2和CO的體積之比是__________。
查看答案和解析>>
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com