
| 序號 | 主要實驗步驟及實驗現象 |
| ① | 在含Y的溶液中,加入稀硫酸放置,產生淺黃色沉淀和無色有刺激性氣味的氣體,該氣體可使品紅溶液褪色 |
| ② | 在含Z的溶液中,滴加鹽酸,開始有白色沉淀,繼續滴加鹽酸,白色沉淀先增加后消失,然后加入過量的氨水又出現白色沉淀 |
| ③ | 將實驗②最終得到的混合物加熱蒸發、灼燒,最終得到白色固體 |
分析 X、Y、Z、W和N均是由短周期元素組成的五種化合物,五種化合物水溶液的焰色反應均呈黃色,均含有Na元素,Y、Z和N均由三種元素組成.
(1)固體化合物X為淺黃色粉末,則X為Na2O2;
(2)過氧化鈉與二氧化碳反應生成碳酸鈉與氧氣;
(3)實驗①在含Y的溶液中,加入稀硫酸放置,產生淺黃色沉淀和無色有刺激性氣味的氣體,該氣體可使品紅溶液褪色,Y為Na2S2O3;
(4)實驗②在含Z的溶液中,滴加鹽酸,開始有白色沉淀,繼續滴加鹽酸,白色沉淀先增加后消失,然后加入過量的氨水又出現白色沉淀,則Z為NaAlO2,HCl物質的量為0.02L×5mol/L=0.1mol,NaAlO2與HCl物質的量之比為1:1,二者恰好發生反應:NaAlO2+HCl+H2O=Al(OH)3↓+NaCl;
實驗③將實驗②最終得到的混合物加熱蒸發、灼燒,氫氧化鋁分解最終得到白色固體為Al2O3;
(5)W與加熱分解得到N,N與二氧化碳、水反應得到W,可知W為NaHCO3、N為Na2CO3,若有NaHCO3和Na2CO3•xH2O的混合物6.52g,加熱到完全反應后,氣體產物通過濃硫酸增重1.71g為結晶水與碳酸氫鈉分解生成水的質量之和,剩余氣體通過堿石灰增重1.10g為碳酸氫鈉分解生成二氧化碳的質量,設NaHCO3和Na2CO3•xH2O的物質的量分別為amol、bmol,結合方程式計算解答.
解答 解:X、Y、Z、W和N均是由短周期元素組成的五種化合物,五種化合物水溶液的焰色反應均呈黃色,均含有Na元素,Y、Z和N均由三種元素組成.
(1)固體化合物X為淺黃色粉末,則X為Na2O2,鈉離子與過氧根離子之間形成離子鍵、過氧根離子中存在非極性鍵,故選:AC;
(2)過氧化鈉與二氧化碳反應生成碳酸鈉與氧氣,反應方程式為:2Na2O2+2CO2=2Na2CO3+O2,
故答案為:2Na2O2+2CO2=2Na2CO3+O2;
(3)實驗①在含Y的溶液中,加入稀硫酸放置,產生淺黃色沉淀和無色有刺激性氣味的氣體,該氣體可使品紅溶液褪色,Y為Na2S2O3,Y與稀硫酸反應的離子方程式:S2O32-+2H+=S↓+SO2↑+H2O,
故答案為:S2O32-+2H+=S↓+SO2↑+H2O;
(4)實驗②在含Z的溶液中,滴加鹽酸,開始有白色沉淀,繼續滴加鹽酸,白色沉淀先增加后消失,然后加入過量的氨水又出現白色沉淀,則Z為NaAlO2,HCl物質的量為0.02L×5mol/L=0.1mol,NaAlO2與HCl物質的量之比為1:1,二者恰好發生反應:NaAlO2+HCl+H2O=Al(OH)3↓+NaCl,反應離子方程式為:AlO2-+H2O+H+=Al(OH)3↓,
實驗③將實驗②最終得到的混合物加熱蒸發、灼燒,氫氧化鋁分解最終得到白色固體為Al2O3,
故答案為:AlO2-+H2O+H+=Al(OH)3↓;Al2O3;
(5)W與加熱分解得到N,N與二氧化碳、水反應得到W,可知W為NaHCO3、N為Na2CO3,若有NaHCO3和Na2CO3•xH2O的混合物6.52g,加熱到完全反應后,氣體產物通過濃硫酸增重1.71g為結晶水與碳酸氫鈉分解生成水的質量之和,剩余氣體通過堿石灰增重1.10g為碳酸氫鈉分解生成二氧化碳的質量,設NaHCO3和Na2CO3•xH2O的物質的量分別為amol、bmol,則:
2NaHCO3$\frac{\underline{\;\;△\;\;}}{\;}$Na2CO3+CO2↑+H2O
amol 0.5amol 0.5amol
Na2CO3.xH2O$\frac{\underline{\;\;△\;\;}}{\;}$Na2CO3+xH2O
bmol xb mol
根據濃硫酸增重,可得:(0.5a+xb)×18=1.71
根據堿石灰增重,可得:0.5a×44=1.10
根據混合物總質量,可得:84a+(106+18x)b=6.52
聯立方程,解得a=0.05,b=0.01,x=7,
則m(2NaHCO3)=0.05mol×84g/mol=4.2g,
N•xH2O的化學式為為:Na2CO3.7H2O,
故答案為:4.2g;Na2CO3.7H2O.
點評 本題考查無機物推斷、化學計算等,物質的顏色、反應現象是推斷突破口,需要學生熟練掌握元素化合物知識,難度中等.


科目:高中化學 來源: 題型:解答題
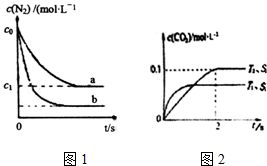 汽車尾氣是城市主要空氣污染物,研究控制汽車尾氣排放是保護環境的首要任務.
汽車尾氣是城市主要空氣污染物,研究控制汽車尾氣排放是保護環境的首要任務.| 時間/s | 0 | 1 | 2 | 3 | 4 | 5 |
| c(NO)/(×10-4mol•L-1) | 10.0 | 4.50 | 2.50 | 1.60 | 1.00 | 1.00 |
| c(CO)/(×10-3mol•L-1) | 3.60 | 3.05 | 2.85 | 2.76 | 2.70 | 2.70 |
查看答案和解析>>
科目:高中化學 來源: 題型:解答題
 .
.查看答案和解析>>
科目:高中化學 來源: 題型:解答題
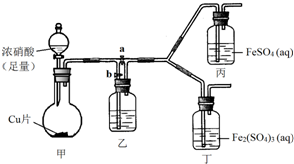 某學生欲通過實驗方法驗證Fe2+的性質.
某學生欲通過實驗方法驗證Fe2+的性質.| 實驗操作 | 預期現象 | 反應的離子方程式 |
| 向盛有新制FeSO4溶液的試管中滴入數滴濃硝酸,振蕩 | 試管中產生紅棕色氣體,溶液顏色逐漸變黃 | Fe2++NO${\;}_{3}^{-}$+2H+=Fe3++NO2↑+H2O |
查看答案和解析>>
科目:高中化學 來源: 題型:解答題
查看答案和解析>>
科目:高中化學 來源: 題型:解答題
| 實驗操作 | 預期現象 | 離子方程式 |
| 向盛有新制FeSO4溶液的試管中滴入數滴濃硝酸,振蕩 | 試管中產生紅棕色氣體,溶液顏色逐漸變黃 | Fe2++NO3-+2H+=Fe3++NO2↑+H2O |
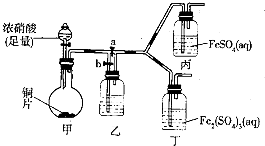
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| A. | Na2SO4 KNO3 Na2CO3 NH4Cl | B. | H2SO4 BaCl2 Na2SO4 NaOH | ||
| C. | MgCl2 AgNO3 KNO3 HCl | D. | NH4HCO3 NaOH NaCl HCl |
查看答案和解析>>
科目:高中化學 來源: 題型:解答題
查看答案和解析>>
科目:高中化學 來源: 題型:多選題
| A. | 甲烷,丙炔 | B. | 甲烷,丁炔 | C. | 乙烷,乙炔 | D. | 乙烷,丙炔 |
查看答案和解析>>
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com