
分枝酸可用于生化研究。其結構簡式如圖。下列關于分枝酸的敘述正確的是( )
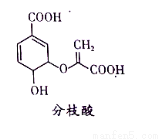
A.分子中含有2種官能團
B.可與乙醇、乙酸反應,且反應類型相同
C.1mol分枝酸最多可與3molNaOH發生中和反應
D.可使溴的四氯化碳溶液、酸性高錳酸鉀溶液褪色,且原理相同
 閱讀快車系列答案
閱讀快車系列答案科目:高中化學 來源:2015-2016學年江西省高一下學期期末考試化學試卷(解析版) 題型:實驗題
利用甲烷與氯氣發生取代反應制取副產品鹽酸的設想在工業上已成為現實。某化學興趣小組通過在實驗室中模擬上述過程,其設計的模擬裝置如下:
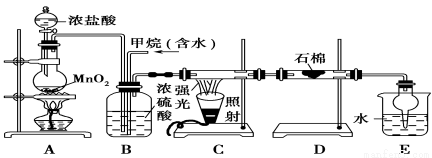
根據設計要求回答:
(1)B裝置有三種功能:①控制氣流速度;②均勻混合氣體;③____________________。
(2)設同一條件下的體積比為:V(Cl2)/V(CH4)=x,若理論上欲獲得最多的氯化氫,則x值應________________________。
(3)D裝置的石棉中均勻混有KI粉末,其作用是________________________________。
(4)在C裝置中,經過一段時間的強光照射,發現硬質玻璃管內壁有黑色小顆粒產生,寫出置換出黑色小顆粒的化學方程式________________________________________。
(5)E裝置除生成鹽酸外,還含有有機物,從E中分離出有機物的最佳方法為________。該裝置還有缺陷,原因是沒有進行尾氣處理,其尾氣主要成分為________(填編號)。
a.CH4 b.CH3Cl c.CH2Cl2 d.CHCl3 e.CCl4
查看答案和解析>>
科目:高中化學 來源:2015-2016學年江西省高一下學期期末考試化學試卷(解析版) 題型:選擇題
下列各圖中能表示化學方程式Fe2O3+2Al 2Fe+Al2O3的是(E表示能量)( )
2Fe+Al2O3的是(E表示能量)( )
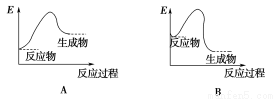
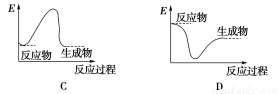
查看答案和解析>>
科目:高中化學 來源:2015-2016學年江西省高二下學期期末考試化學試卷(解析版) 題型:實驗題
香豆素是一種天然香料,存在于黑香豆、蘭花等植物中。工業上常用水楊醛與乙酸酐在催化劑存在下加熱反應制得:
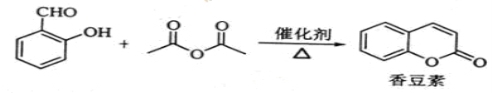
以下是由甲苯為原料生產香豆素的一種合成路線(部分反應條件及副產物已略去)
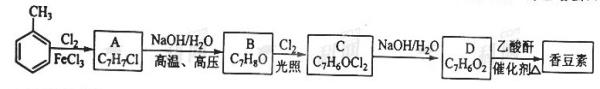
已知以下信息:
1、A中有五種不同化學環境的氫
2、B可與FeCl3溶液發生顯色反應
3、同一個碳原子上連有兩個羥基通常不穩定,易脫水形成羰基。
請回答下列問題:
(1) 香豆素的分子式為______________;
(2) 由B生成C的化學反應方程式為____________________________________________;
(3) B的同分異構體中含有苯環的還有________________種,其中在核磁共振氫譜中只出現四組峰的有
_________________種;
(4)D的同分異構體中含有苯環的既能發生銀鏡反應,又能發生水解反應的是______________________(寫結構簡式)
查看答案和解析>>
科目:高中化學 來源:2015-2016學年江西省高二下學期期末考試化學試卷(解析版) 題型:選擇題
某烴與氫氣發生反應后能生成(CH3)2CHCH2CH3,則該烴不可能( )
A.2-甲基-2-丁烯
B.3-甲基-1-丁烯
C.2,3-二甲基-1-丁烯
D.2-甲基-1,3-丁二烯
查看答案和解析>>
科目:高中化學 來源:2015-2016學年江蘇省揚州市高二選修下學期期末調研化學試卷(解析版) 題型:填空題
將過量的氨水加到硫酸銅溶液中,溶液最終變成深藍色,繼續加入乙醇,析出晶體Cu(NH3)4SO4·H2O。
(1)Cu2+基態核外電子排布式為 ;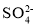 的空間構型為 。(用文字描述)
的空間構型為 。(用文字描述)
(2)乙醇分子中氧原子軌道雜化類型為 。與NH3互為等電子體的一種陽離子為 (填化學式)。
(3)1mol[Cu(NH3)4]2+中σ鍵的數目為 。
(4)某含有結晶水的銅的氯化物的晶胞結構如圖所示,該化合物的化學式是 。
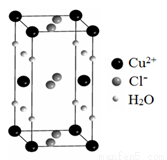
查看答案和解析>>
科目:高中化學 來源:2015-2016學年江蘇省揚州市高二選修下學期期末調研化學試卷(解析版) 題型:選擇題
常溫下,下列各組離子一定能在指定溶液中大量共存的是
A.pH=1的無色溶液中: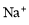 、
、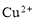 、
、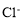 、
、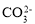
B.0.1 mol·L-1 AlCl3溶液中: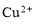 、
、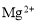 、
、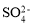 、
、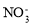
C.由水電離產生的c(H+)=10-12 mol·L-1的溶液中: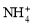 、
、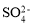 、
、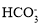 、
、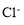
D.0.1 mol·L-1 KSCN溶液中: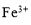 、
、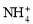 、
、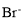 、
、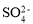
查看答案和解析>>
科目:高中化學 來源:2015-2016學年陜西西安高新一中高一下期末化學試卷(解析版) 題型:選擇題
利用I2O5可消除CO污染,反應為I2O5(s)+5CO(g)  5CO2(g)+I2(s);不同溫度下,向裝有足量I2O5固體的2 L恒容密閉容器中通入2 mol CO,測得CO2氣體體積分數φ(CO2)隨時間t變化曲線如圖所示。下列說法正確的是
5CO2(g)+I2(s);不同溫度下,向裝有足量I2O5固體的2 L恒容密閉容器中通入2 mol CO,測得CO2氣體體積分數φ(CO2)隨時間t變化曲線如圖所示。下列說法正確的是

A.b點時,CO的轉化率為20%
B.容器內的壓強保持恒定,表明反應達到平衡狀態
C.b點和d點的化學平衡常數:Kb>Kd
D.0到0.5min反應速率v(CO)=0.3 mol·L-1·min-1
【答案】C
【解析】
試題分析: A.5CO(g) +I2O5(s)  5CO2(g)+I2(s)
5CO2(g)+I2(s)
起始量/mol 2 0
轉化量/mol y y
b點量/mol 2-y y
根據b點時CO2的體積分數φ(CO2)=y÷2=0.80,得y=1.6mol,轉化率等于=(變化量÷起始量)×100%=(1.6÷2)×100%=80%,錯誤;B.兩邊計量數相等,所以壓強始終不變,不能做平衡狀態的標志,錯誤;C.b點比d點時生成物CO2體積分數大,說明進行的程度大,則化學平衡常數:Kb>Kd,正確;
D.0到0.5min時:5CO(g) +I2O5(s)  5CO2(g)+I2(s)
5CO2(g)+I2(s)
起始量/mol 2 0
轉化量/mol x x
a點量/mol 2-x x
根據a點時CO2的體積分數φ(CO2)=x÷2=0.30,得x=0.6mol;則從反應開始至a點時的反應速率為v(CO)=(0.6mol÷2L)÷0.5min=0.6 mol·L-1·min-1,錯誤。
考點:考查影響化學反應速率和化學平衡影響的因素的知識。
【題型】選擇題
【適用】較難
【標題】【百強校】2015-2016學年陜西西安高新一中高一下期末化學試卷(帶解析)
【關鍵字標簽】
【結束】
已知W、X、Y、Z為短周期元素,W、Z同主族,X、Y、Z同周期,W的氣態氫化物的穩定性大于Z的氣態氫化物的穩定性,X、Y為金屬元素,X的陽離子的氧化性小于Y的陽離子的氧化性.下列說法正確的是
A. X、Y、Z、W的原子半徑依次減小
B. 若W與Y的原子序數相差5,則二者形成化合物的化學式可能為Y2W3
C. W的氣態氫化物的沸點一定高于Z的氣態氫化物的沸點
D. W與X形成的化合物只含離子鍵
查看答案和解析>>
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com