
| T | 298K | 398K | 498K | … |
| K | 4.1×106 | K1 | K2 | … |
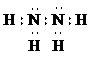
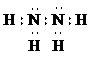
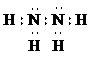 ,肼分子中共價鍵屬于極性鍵,正負電荷的重心不重合,屬于極性分子,
,肼分子中共價鍵屬于極性鍵,正負電荷的重心不重合,屬于極性分子,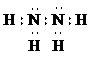 ;極;
;極;

 寒假大串聯黃山書社系列答案
寒假大串聯黃山書社系列答案 寒假創新型自主學習第三學期寒假銜接系列答案
寒假創新型自主學習第三學期寒假銜接系列答案科目:高中化學 來源: 題型:
氮元素有著多變價態和種類繁多的化合物,它們在工農業生產、生活中發揮著重要的作用。完成下列問題:
(1)在一密閉容器中,進行如下化學反應:
N2(g)+3H2(g)![]() 2NH3(g) △H<0,其化學平衡常數K與溫度T的關系如下表:
2NH3(g) △H<0,其化學平衡常數K與溫度T的關系如下表:
| T | 298 K | 398 K | 498 K | … |
| K | 4.1×106 | K1 | K2 | … |
①比較K1、K2的大小:K1______K2(填“>”、“=”或“<”)。
②若保持容器的容積不變,則該反應達到化學平衡狀態的依據是________(填序號)。
a.2v(H2)正=3v(NH3)逆 b.v(N2)正=3v(H2)逆
c.容器內壓強保持不變 d.混合氣體的平均摩爾質量保持不變
③若維持容器的壓強不變,達到平衡狀態后再向容器中通入一定量的N2,此時逆反應速率______(填“增大”、“減小”或“不變”);平衡向_____方向移動。
④已知AgCl可溶于氨水中,而AgBr不溶于氨水中,則Ksp(AgCl)______ Ksp(AgBr)。
( 2 )肼是氮元素的另一種氫化物,分子式為N2H4。
①298 K時,1.00 g N2H4(l)與足量的N2O4(l)完全反應生成氮氣和水,放出19.15 kJ的熱量。寫該反應的熱化學方程式_____________________________________。
②肼也可以在純氧中燃燒生成氮氣和水,為了充分利用其能量有人設計了原電池裝置,電極材料是多孔石墨電極,電解質為能夠傳導H+的固體電解質,請寫出負極反應式_________________。
查看答案和解析>>
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com