
【題目】一種利用鈦鐵礦制備Li4Ti5O12的工藝流程如圖:

已知:鈦鐵礦的主要成分是FeTiO3(可表示為FeO·TiO2),還含有少量的MgO和SiO2等雜質(zhì)。
回答下列問題:
(1)酸浸時(shí),要提高鐵的浸出率可采取的措施是___(寫出一條即可)。
(2)酸浸后的濾液①中鈦主要以TiOCl42-形式存在,則其水解生成TiO2·xH2O的離子方程式為___,加熱水的目的是___。
(3)TiO2·xH2O沉淀與雙氧水、氨水反應(yīng)時(shí),應(yīng)將溫度控制在50℃左右的原因是___。
(4)若將濾液②加熱至一定溫度后,再加入雙氧水和磷酸,恰好使Mg2+沉淀完全[溶液中c(Mg2+)降至1.0×10-5mol·L-1],此時(shí)溶液中![]() =___。已知:此溫度下,FePO4、Mg3(PO4)2的溶度積常數(shù)分別為1.5×10-21、1.0×10-23。
=___。已知:此溫度下,FePO4、Mg3(PO4)2的溶度積常數(shù)分別為1.5×10-21、1.0×10-23。
(5)高溫煅燒時(shí)發(fā)生反應(yīng)的化學(xué)反應(yīng)方程式為___。
(6)某可充電的鋰離子電池以Li4Ti5O12為正極,嵌入鋰的碳材料為負(fù)極,含Li+導(dǎo)電固體為電解質(zhì)。放電時(shí)的電池反應(yīng)為LixC+Li4Ti5O12=Li(x-5)C+Li9Ti5O12,則充電時(shí)陰極電極反應(yīng)式為___。
【答案】提高溫度或?qū)⒌V石粉粹或適當(dāng)提高酸的濃度等 TiOCl42-+(x+1)H2OTiO2·xH2O↓+2H++4Cl- 促進(jìn)水解 提高反應(yīng)速率,同時(shí)防止溫度過高造成雙氧水分解,氨水揮發(fā) 1.5×10-12 Li2Ti5O11+Li2CO3![]() Li4Ti5O12+CO2↑ Li(x-5)C+5Li++5e-=LixC
Li4Ti5O12+CO2↑ Li(x-5)C+5Li++5e-=LixC
【解析】
用鈦鐵礦(主要成分為FeTiO3,還含有少量MgO、SiO2等雜質(zhì))來制備Li4Ti5O12,由制備流程可知,加鹽酸酸浸溶解,SiO2與鹽酸不反應(yīng),過濾后的濾渣為SiO2,濾液①中含Mg2+、Fe2+、TiOCl42-,對濾液①加熱發(fā)生水解反應(yīng)TiOCl42-+(x+1)H2OTiO2·xH2O↓+2H++4Cl-,水解后過濾,水解后的濾液②中含Mg2+、Fe2+,沉淀為TiO2xH2O,向沉淀中加入氨水、雙氧水和LiOH反應(yīng)過濾后得到Li2Ti5O15,再與碳酸鋰高溫下發(fā)生反應(yīng)Li2Ti5O11+Li2CO3![]() Li4Ti5O12+CO2↑生成Li4Ti3O12,據(jù)此分析解答。
Li4Ti5O12+CO2↑生成Li4Ti3O12,據(jù)此分析解答。
(1)酸浸時(shí),要提高鐵的浸出率可采取的措施是提高溫度或?qū)⒌V石粉粹或適當(dāng)提高酸的濃度等;
(2)酸浸后的濾液①中鈦主要以TiOCl42-形式存在,則其水解生成TiO2·xH2O的離子方程式為TiOCl42-+(x+1)H2OTiO2·xH2O↓+2H++4Cl-,加熱水的目的是促進(jìn)水解;
(3)TiO2·xH2O沉淀與雙氧水、氨水反應(yīng)時(shí),雙氧水受熱易分解,氨水受熱易揮發(fā),應(yīng)將溫度控制在50℃左右的原因是提高反應(yīng)速率,同時(shí)防止溫度過高造成雙氧水分解,氨水揮發(fā);
(4)若將濾液②加熱至一定溫度后,再加入雙氧水和磷酸,恰好使Mg2+沉淀完全[溶液中c(Mg2+)降至1.0×10-5mol·L-1],根據(jù)Ksp[Mg3(PO4)2]=c3(Mg2+)×c2(PO43-),c(PO43-)=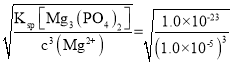 =1.0×10-4mol·L-1,Ksp(FePO4)=c(Fe3+)×c(PO43-),c(Fe3+) =
=1.0×10-4mol·L-1,Ksp(FePO4)=c(Fe3+)×c(PO43-),c(Fe3+) = 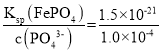 =1.5×10-17 mol·L-1,此時(shí)溶液中
=1.5×10-17 mol·L-1,此時(shí)溶液中![]() =
=![]() =1.5×10-12;
=1.5×10-12;
(5)根據(jù)分析,高溫煅燒時(shí)發(fā)生反應(yīng)的化學(xué)反應(yīng)方程式為Li2Ti5O11+Li2CO3![]() Li4Ti5O12+CO2↑;
Li4Ti5O12+CO2↑;
(6)某可充電的鋰離子電池以Li4Ti5O12為正極,嵌入鋰的碳材料為負(fù)極,含Li+導(dǎo)電固體為電解質(zhì)。放電時(shí)的電池反應(yīng)為LixC+Li4Ti5O12=Li(x-5)C+Li9Ti5O12,則充電時(shí)為電解池,是放電時(shí)的逆過程,充電時(shí)的總反應(yīng)為:Li(x-5)C+Li9Ti5O12![]() LixC+Li4Ti5O12,陰極上得電子,發(fā)生還原反應(yīng),電極反應(yīng)式為Li(x-5)C+5Li++5e-=LixC。
LixC+Li4Ti5O12,陰極上得電子,發(fā)生還原反應(yīng),電極反應(yīng)式為Li(x-5)C+5Li++5e-=LixC。



| 年級 | 高中課程 | 年級 | 初中課程 |
| 高一 | 高一免費(fèi)課程推薦! | 初一 | 初一免費(fèi)課程推薦! |
| 高二 | 高二免費(fèi)課程推薦! | 初二 | 初二免費(fèi)課程推薦! |
| 高三 | 高三免費(fèi)課程推薦! | 初三 | 初三免費(fèi)課程推薦! |
科目:高中化學(xué) 來源: 題型:
【題目】某小組同學(xué)為探究H2O2、H2SO3、Br2氧化性強(qiáng)弱,設(shè)計(jì)如下實(shí)驗(yàn)(夾持儀器已略去,裝置的氣密性已檢驗(yàn))。

實(shí)驗(yàn)記錄如下:

請回答下列問題:
(1)A中反應(yīng)的離子方程式是__________________________________________________。
(2)實(shí)驗(yàn)操作Ⅱ吹入熱空氣的目的是_________________________________________。
(3)裝置C的作用是____________,C中盛放的藥品是_____________。
(4)實(shí)驗(yàn)操作Ⅲ,混合液逐漸變成紅棕色,其對應(yīng)的離子方程式_______________________。
(5)由上述實(shí)驗(yàn)得出的結(jié)論是_________________________________________________。
(6)實(shí)驗(yàn)反思:
①有同學(xué)認(rèn)為實(shí)驗(yàn)操作Ⅱ吹入的熱空氣,會干擾(5)中結(jié)論的得出,你認(rèn)為是否干擾,理由是_____________________________________________________________________。
②實(shí)驗(yàn)操作Ⅲ,開始時(shí)顏色無明顯變化的原因是(寫出一條即可):____________________。
查看答案和解析>>
科目:高中化學(xué) 來源: 題型:
【題目】在體積為2L的恒容密閉容器中充入一定量的SO2和O2,發(fā)生反應(yīng):2SO2(g)+O2(g) ![]() 2SO3(g)反應(yīng)在三種不同的條件下進(jìn)行,反應(yīng)物SO2的物質(zhì)的量(mol)隨反應(yīng)時(shí)間(min)的變化情況如下表所示:
2SO3(g)反應(yīng)在三種不同的條件下進(jìn)行,反應(yīng)物SO2的物質(zhì)的量(mol)隨反應(yīng)時(shí)間(min)的變化情況如下表所示:
實(shí)驗(yàn)序號 | 時(shí)間 物質(zhì)的量 溫度 | 0 | 5 | 10 | 15 | 20 | 25 | 30 |
1 | 490℃ | 2.00 | 1.00 | 0.50 | 0.30 | 0.25 | 0.20 | 0.20 |
2 | 490℃ | 2.00 | 0.30 | 0.20 | 0.20 | 0.20 | 0.20 | 0.20 |
3 | 500℃ | 2.00 | 0.50 | 0.35 | 0.30 | 0.30 | 0.30 | 0.30 |
(1)對照實(shí)驗(yàn)1,實(shí)驗(yàn)2改變的某一外界條件可能是_______。
(2)反應(yīng)達(dá)平衡后,向?qū)嶒?yàn)2中加入少量的18O2,一段時(shí)間18O后可能存在于哪些物質(zhì)中________(填選項(xiàng))。
A 只存在氧氣 B 只存在三氧化硫 C 只存在反應(yīng)物 D 存在反應(yīng)物與生成物
(3)實(shí)驗(yàn)3中,在5~15min時(shí)段,用O2表示的平均反應(yīng)速率為______ mol/(L·min)。
(4)若將實(shí)驗(yàn)1置于絕熱體系中,測得實(shí)驗(yàn)到達(dá)平衡的時(shí)間比原來縮短了,則參加反應(yīng)的SO2和O2的總能量______(填“>”、“<”或“=”)生成的SO3的總能量。
(5)能說明實(shí)驗(yàn)3達(dá)到平衡狀態(tài)的標(biāo)志是_______(任寫一條)。
查看答案和解析>>
科目:高中化學(xué) 來源: 題型:
【題目】某溫度下,在2L密閉容器中充入4molA氣體和3molB氣體,發(fā)生下列反應(yīng):2A(g)+B(g) ![]() C(g)+xD(g),5s達(dá)到平衡。達(dá)到平衡時(shí),生成了1mol C,測定D的濃度為1mol/L。
C(g)+xD(g),5s達(dá)到平衡。達(dá)到平衡時(shí),生成了1mol C,測定D的濃度為1mol/L。
(1)求x =____。
(2)求這段時(shí)間A的平均反應(yīng)速率為_____。
(3)平衡時(shí)B的濃度為______。
(4)下列敘述能說明上述反應(yīng)達(dá)到平衡狀態(tài)的是_____
A 單位時(shí)間內(nèi)每消耗2 mol A,同時(shí)生成1molC
B 單位時(shí)間內(nèi)每生成1molB,同時(shí)生成1mol C
C D的體積分?jǐn)?shù)不再變化
D 混合氣體的壓強(qiáng)不再變化
E B、C的濃度之比為1∶1
查看答案和解析>>
科目:高中化學(xué) 來源: 題型:
【題目】用電解法測量某工業(yè)廢氣中CO的濃度,工作原理如圖所示。下列說法不正確的是
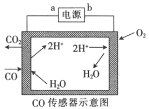
A.b為電源的負(fù)極B.陽極的電極反應(yīng)式為CO+H2O-2e-=CO2+2H+
C.H+向陰極移動D.理論上每消耗11.2 L O2,轉(zhuǎn)移2mol電子
查看答案和解析>>
科目:高中化學(xué) 來源: 題型:
【題目】在體積可變的密閉容器中發(fā)生可逆反應(yīng):2NO2(g)![]() 2NO(g)+O2(g)。能作為反應(yīng)達(dá)到平衡狀態(tài)的標(biāo)志是
2NO(g)+O2(g)。能作為反應(yīng)達(dá)到平衡狀態(tài)的標(biāo)志是
A.單位時(shí)間內(nèi)生成n mol O2的同時(shí)生成n mol NO2
B.NO2、NO、O2三者的物質(zhì)的量濃度之比為2:2:1
C.混合氣體的密度不再改變
D.容器中氣體壓強(qiáng)不再變化
查看答案和解析>>
科目:高中化學(xué) 來源: 題型:
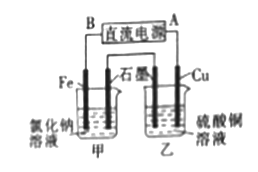
【題目】宇宙飛船上使用的氫氧燃料電池是一種新型化學(xué)電池,其結(jié)構(gòu)如圖所示,A、B是多孔性碳制成的兩個(gè)電極。
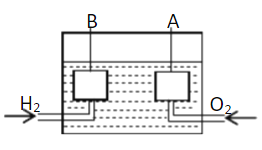
(1)該燃料電池的正極是 (填“A”或“B”),若電解質(zhì)溶液為KOH溶液,則負(fù)極的電極反應(yīng)式為 ;一段時(shí)間后,溶液的pH會 (填“變大”“變小”或“不變”)。
(2)若電解質(zhì)溶液為硫酸,則正極的反應(yīng)式為 。
(3)若用該氫氧燃料電池作電源電解氯化鈉溶液和硫酸銅溶液,裝置如圖所示,則鐵電極上產(chǎn)生的氣體為 (填化學(xué)式);一段時(shí)間后,銅電極的質(zhì)量減少6.4g,則甲池中石墨電極上產(chǎn)生氣體的物質(zhì)的量為 。
查看答案和解析>>
科目:高中化學(xué) 來源: 題型:
【題目】常溫下,0.2mol/L的一元堿BOH與等濃度的HCl溶液等體積混合后,所得溶液中部分微粒組分及濃度如圖所示,下列說法正確的是( )
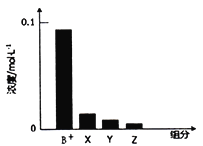
A. BOH為強(qiáng)堿 B. 該混合液pH=7
C. 圖中X表示BOH,Y表示H+,Z表示OH- D. 該混合溶液中:c(Cl-)=c(Y)+c(B+)
查看答案和解析>>
科目:高中化學(xué) 來源: 題型:
【題目】鹽酸與碳酸鈣反應(yīng)生成CO2,運(yùn)用下圖,可測定該反應(yīng)的速率.請根據(jù)要求填空:
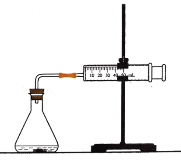
(1)連接好儀器后,需要檢查_____________________,再加入藥品進(jìn)行實(shí)驗(yàn).
(2)在錐形瓶中加入5g大理石,加入20mL 1mol·L1鹽酸.每隔10s觀測玻璃注射器中氣體的體積,并以mL·s1為反應(yīng)速率的單位,計(jì)算每10s時(shí)間間隔內(nèi)的反應(yīng)速率。數(shù)據(jù)處理的結(jié)果見下面的表格:
時(shí)間/s | 10 | 20 | 30 | 40 | 50 | 60 |
氣體體積/mL | 4 | 14 | 25 | 38 | 47 | 55 |
反應(yīng)速率/mL·s1 | 0.4 | 1.0 | 1.1 | ? | 0.9 | 0.8 |
表格中的“?”處應(yīng)填的數(shù)據(jù)是_________________.
(3)從反應(yīng)速率隨時(shí)間變化的數(shù)據(jù)可知,本實(shí)驗(yàn)中反應(yīng)速率與___________和__________有關(guān)
查看答案和解析>>
湖北省互聯(lián)網(wǎng)違法和不良信息舉報(bào)平臺 | 網(wǎng)上有害信息舉報(bào)專區(qū) | 電信詐騙舉報(bào)專區(qū) | 涉歷史虛無主義有害信息舉報(bào)專區(qū) | 涉企侵權(quán)舉報(bào)專區(qū)
違法和不良信息舉報(bào)電話:027-86699610 舉報(bào)郵箱:58377363@163.com