
| ① | A1 | B1 | C1 | D1 |
| 電子數 | 10 | 10 | 10 | 18 |
| ② | A2 | B2 | C2 | D2 |
| 電子數 | 10 | 10 | 10 | 18 |
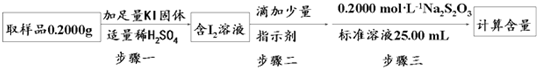
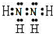 ,
, ;
;

科目:高中化學 來源: 題型:
查看答案和解析>>
科目:高中化學 來源: 題型:
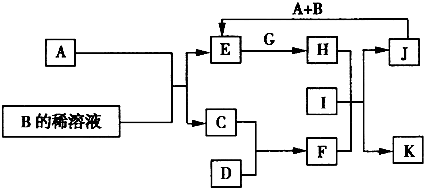
 A-L為中學化學常見物質,其主要轉化關系如圖所示(其中產物水已略去).已知A為金屬單質,C、D通常狀況下為氣體單質.B、F均為重要的化工產品,F為具有刺激性氣味的氣體,將一定量F通入B的稀溶液中可以得到兩種鹽K和L.G和I分別由相同的兩種元素組成,通常狀況下均為無色液體.
A-L為中學化學常見物質,其主要轉化關系如圖所示(其中產物水已略去).已知A為金屬單質,C、D通常狀況下為氣體單質.B、F均為重要的化工產品,F為具有刺激性氣味的氣體,將一定量F通入B的稀溶液中可以得到兩種鹽K和L.G和I分別由相同的兩種元素組成,通常狀況下均為無色液體.查看答案和解析>>
科目:高中化學 來源: 題型:
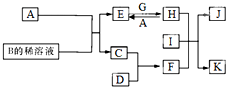 A~L為中學化學常見物質,其主要轉化關系如圖所示(其中產物水已略去).已知A為金屬單質,C、D通常狀況下為氣體單質.B、F均為重要的化工產品,F為具有刺激性氣味的氣體,可使濕潤的紅色石蕊試紙變藍.G和I分別由相同的兩種元素組成,通常狀況下均為無色液體.
A~L為中學化學常見物質,其主要轉化關系如圖所示(其中產物水已略去).已知A為金屬單質,C、D通常狀況下為氣體單質.B、F均為重要的化工產品,F為具有刺激性氣味的氣體,可使濕潤的紅色石蕊試紙變藍.G和I分別由相同的兩種元素組成,通常狀況下均為無色液體.查看答案和解析>>
科目:高中化學 來源:2010-2011學年東北師大附中、哈師大附中,遼寧實驗中學三校高三第二次聯合模擬考試(理綜 題型:填空題
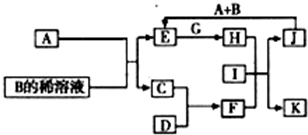
A~L為中學化學常見物質,其主要轉化關系如下圖所示(其中產物水已略去)。已知A為金屬單質,C、D通常狀況下為氣體單質。B、F均為重要的化工產品,F為具有刺激性氣味的氣體,將一定量F通入B的稀溶液中可以得到兩種鹽K和L。G和I分別由相同的兩種元素組成,通常狀況下均為無色液體。
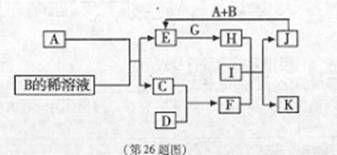
(1)B的化學式為 ;工業上冶煉金屬A的方法稱為 。
(2)向E的溶液中加入氫氧化鈉溶液的實驗現象為 ,反應的化學方程式為 。
(3)寫出E的酸性溶液與G反應轉化為H的離子方程式 。
(4)相同條件下物質的量濃度相同的K、L溶液的pH大小關系為K L(用“>”、“<”或“=”表示),其主要原因是(用化學用語說明) 。
查看答案和解析>>
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com