【答案】
分析:(1)利用排水測定生成氫氣的體積,廣口瓶中進氣導管不應插入水中,排水導管應插到廣口瓶底部;
(2)分子中有三種不同化學環境的氫,三種不同的氫與鈉反應,或相互組合與鈉反應,據此計算;
(3)分子中只有一種氫,據此計算;
(4)計算出每摩爾乙醇與鈉反應所提供的氫原子;
(5)該實驗原理是測出一定量乙醇與鈉反應(放熱)生成氫氣的體積,并據此計算乙醇分子中能與金屬鈉反應的氫原子的數目,據此解答.
解答:解:(1)利用排水測定生成氫氣的體積,廣口瓶中進氣導管不應插入水中,排水導管應插到廣口瓶底部,
故答案為:廣口瓶中進氣導管不應插入水中,排水導管應插到廣口瓶底部;
(2)若乙醇結構是CH
3CH
2OH,令CH
3CH
2OH的物質的量為1mol;
只有羥基上的氫反應,根據氫原子守恒,生成氫氣的物質的量為0.5mol,參加反應的乙醇的物質的量與產生氫氣的物質的量之比為1:0.5;
只有甲基上的氫反應,根據氫原子守恒,生成氫氣的物質的量為1.5mol,參加反應的乙醇的物質的量與產生氫氣的物質的量之比為1:1.5;
只有亞甲基上的氫反應,根據氫原子守恒,生成氫氣的物質的量為1mol,參加反應的乙醇的物質的量與產生氫氣的物質的量之比為1:1;
若甲基、亞甲基上的氫反應,根據氫原子守恒,生成氫氣的物質的量為2.5mol,參加反應的乙醇的物質的量與產生氫氣的物質的量之比為1:2.5;
若甲基、羥基上的氫反應,根據氫原子守恒,生成氫氣的物質的量為2mol,參加反應的乙醇的物質的量與產生氫氣的物質的量之比為1:2;
若亞甲基、羥基上的氫反應,根據氫原子守恒,生成氫氣的物質的量為1.5mol,參加反應的乙醇的物質的量與產生氫氣的物質的量之比為1:1.5;
若甲基、亞甲基上、羥基的氫全部反應,根據氫原子守恒,生成氫氣的物質的量為3mol,參加反應的乙醇的物質的量與產生氫氣的物質的量之比為1:3;
故答案為:1:0.5; 1:1.5; 1:1; 1:2.5;1:2;1:3.
(3)若乙醇結構是CH
3OCH
3,令CH
3OCH
3的物質的量為1mol;
甲基上的氫全部反應,根據氫原子守恒,生成氫氣的物質的量為3mol,參加反應的乙醇的物質的量與產生氫氣的物質的量之比為1:3.
故答案為:1:3;
(4)2.3g乙醇的物質的量為
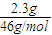
=0.05mol,
標準狀況下0.56L氫氣的物質的量為
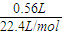
=0.025mol,
所以每摩爾乙醇與鈉反應提供的氫原子為
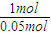
×0.025mol×2=1mol,
所以,乙醇的結構應為CH
3CH
2OH,故答案為:CH
3CH
2OH;1mol乙醇中只有1mol活潑H;
(5)該實驗原理是測出一定量乙醇與鈉反應(放熱)生成氫氣的體積,并據此計算乙醇分子中能與金屬鈉反應的氫原子的數目,據此推斷結構.
氣密性好才能收集到氣體;
乙醇的量,氫氣的體積準確,定量計算結論才正確;
鈉足量才能保證乙醇完全反應;
由于2.3g乙醇與足量金屬鈉反應時產生了標準狀況下的氫氣約0.56L,所以廣口瓶中水的體積大于560mL;
故選:①②③④⑤.
點評:本題的解題關鍵在于清楚實驗原理,即測出一定量乙醇與鈉反應(放熱)生成氫氣的體積,并據此計算乙醇分子中能與金屬鈉反應的氫原子的數目,難度不大.


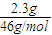 =0.05mol,
=0.05mol,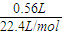 =0.025mol,
=0.025mol,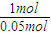 ×0.025mol×2=1mol,
×0.025mol×2=1mol,

 某中學化學興趣小組對乙醇的分子結構進行探究,
某中學化學興趣小組對乙醇的分子結構進行探究, 水不僅是生命之源,而且飲用水的質量問題已經日益受到人們的關注!
水不僅是生命之源,而且飲用水的質量問題已經日益受到人們的關注!