
【題目】乙酸是生物油的主要成分之一,乙酸制氫具有重要意義:
反應I(熱裂解):CH3COOH(g)2CO(g)+2H2(g) △H1
反應II(脫羧基):CH3COOH(g)CH4(g)+CO2(g) △H2
已知:反應I的活化能為(E5-E2)kJ,反應I逆反應的活化能為(E5-E3)kJ,反應II的活化能為(E4-E2)kJ,反應II逆反應的活化能為(E4-E1)kJ,E1到E5能量依次增大
(1)△H1+△H2=___________kJ/mol (用有關E的代數式表示);
(2)在不同溫度下,向密閉容器中充入等量醋酸蒸汽,反應相同時間后,測得各氣體的產率與溫度的關系如圖所示:

①約650℃之前,氫氣產率低于甲烷的原因是;________________________________;
②約650℃之后,隨著溫度升高后,氫氣產率高于甲烷的原因是:___________;(填編號)
a. 反應II速率減慢
b. 反應I速率加快的程度比反應II大
c. 反應I正向移動,而反應II逆向移動
d. 反應I正向移動的程度大于反應II正向移動的程度
③根據圖像分析,該容器中一定發生了另外的副反應,理由是:______________。
(3)投入一定量的乙酸,在相同壓強下,經過相同反應時間測得如下實驗數據:
溫度(℃) | 催化劑 | CH3COOH轉化率 | H2的選擇性 |
550 | 甲 | 14.5 | 40.2 |
550 | 乙 | 11.1 | 62.1 |
600 | 甲 | 11.2 | 41.2 |
600 | 乙 | 10.3 | 63.3 |
(H2的選擇性:轉化的CH3COOH中生成H2的百分比)
①表中實驗數據表明,在相同溫度下不同的催化劑對CH3COOH轉化成H2的選擇性有顯著的影響,其原因是________。
②有利于提高CH3COOH轉化為H2平衡轉化率的措施有________。
A.使用催化劑甲 B.使用催化劑乙
C.升高反應溫度 D.增加反應物的濃度
【答案】E1+E3-2E2 反應I的活化能高于反應II,使生成H2的速率低于生成CH4的速率 bc 根據反應I看出,生成CO與H2的比例為1:1,但圖像中這兩種氣體的產率顯然非1:1。 此時反應未達到平衡,不同的催化劑對反應Ⅰ的催化能力不同,因而在該時刻下對甲醇選擇性有影響。 C 16.7% ![]()
【解析】
(1)已知:反應I的活化能為(E5-E2)kJ,反應I逆反應的活化能為(E5-E3)kJ,反應II的活化能為(E4-E2)kJ,反應II逆反應的活化能為(E4-E1)kJ,E1到E5能量依次增大,根據上述關系,畫出圖像分析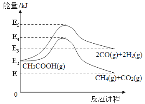 ,根據△H=生成物總能量-反應物總能量計算;
,根據△H=生成物總能量-反應物總能量計算;
(2)①約650℃之前,脫酸基反應活化能低速率快,故氫氣產率低于甲烷;
②熱裂解反應CH3COOH(g)→2CO(g)+2H2(g)正向是吸熱反應,升高溫度有利于反應正向進行,并且平衡進行的程度增大,而脫酸基反應CH3COOH(g)CH4(g)+CO2(g)正向是放熱反應,升高溫度,反應會逆向進行,并且平衡進行的程度減小,據此解答;
③圖象分析可知,反應Ⅰ生成CO與H2的比例為1:1,結合圖象中氣體物質的量之比分析判斷;
(3)①不同的催化劑的催化能力不同,且催化劑具有選擇性;
②CH3COOH(g)2CO(g)+2H2(g)正向是吸熱反應,提高CH3COOH轉化為H2平衡轉化率,應使平衡正向移動,可升高溫度,減小生成物的濃度;
(4)設起始時n(CH3COOH)=1mol,熱裂解反應消耗乙酸40%,根據熱裂解反應CH3COOH(g)2CO(g)+2H2(g)有n(CO)=n(H2)=0.4mol×2=0.8mol,脫酸基反應消耗乙酸20%,根據脫酸基反應CH3COOH(g)CH4(g)+CO2(g)有n(CH4)=n(CO2)=0.2mol,平衡時剩余n(CH3COOH)=1mol0.4mol0.2mol=0.4mol,根據體積分數公式和壓強平衡常數表達式分別計算。
(1)已知:反應I的活化能為(E5-E2)kJ,反應I逆反應的活化能為(E5-E3)kJ,反應II的活化能為(E4-E2)kJ,反應II逆反應的活化能為(E4-E1)kJ,E1到E5能量依次增大,根據上述關系,畫出圖像分析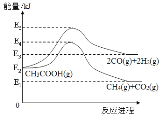 ,根據△H=生成物總能量-反應物總能量可得,△H1=E3-E2,△H2=E1-E2,則△H1+△H2= E3-E2+E1-E2= E3+E1-2E2;
,根據△H=生成物總能量-反應物總能量可得,△H1=E3-E2,△H2=E1-E2,則△H1+△H2= E3-E2+E1-E2= E3+E1-2E2;
(2)①約650℃之前,脫酸基反應活化能低速率快,反應I的活化能高于反應II,使生成H2的速率低于生成CH4的速率,故氫氣產率低于甲烷;
②根據(1)畫出的圖像分析熱裂解反應CH3COOH(g)2CO(g)+2H2(g)正向是吸熱反應,升高溫度有利于反應正向進行,并且平衡進行的程度增大,使H2的生成量增多,而脫酸基反應CH3COOH(g)CH4(g)+CO2(g)正向是放熱反應,升高溫度,反應會逆向進行,使CH4的生成量減少,所以隨著溫度升高后,熱裂解反應速率加快,同時氫氣產率高于甲烷,故選bc;
③反應Ⅰ(熱裂解):CH3COOH(g)2CO(g)+2H2(g)根據反應I看出,生成CO與H2的比例為1:1,但圖像中這兩種氣體的產率顯然非1:1,說明該容器中一定發生了另外的副反應;
(3)①由圖上的數據可以知道在一定時間內,反應未達到平衡,不同的催化劑對反應Ⅰ的催化能力不同,因而在該時刻下對甲醇選擇性有影響;
②A.催化劑無法改變平衡轉化率,故A錯誤;
B.催化劑無法改變平衡轉化率,故B錯誤;
C.反應I為吸熱反應,所以升高溫度,平衡正向進行,轉化率增大,故C正確;
D.增大反應物的濃度,能使平衡正向進行,但不能增大CH3COOH的轉化率,故D錯誤;
答案選C。
(4)設起始時n(CH3COOH)=1mol,熱裂解反應消耗乙酸40%,根據熱裂解反應CH3COOH(g)2CO(g)+2H2(g)有n(CO)=n(H2)=0.4mol×2=0.8mol,脫酸基反應消耗乙酸20%,根據脫酸基反應CH3COOH(g)CH4(g)+CO2(g)有n(CH4)=n(CO2)=0.2mol,剩余n(CH3COOH)=1mol0.4mol0.2mol=0.4mol,所以平衡時乙酸體積分數![]() ×100%=16.7%;平衡時p(CO)=p(H2)=
×100%=16.7%;平衡時p(CO)=p(H2)=![]() ×p=
×p=![]() ,p(CH3COOH)=
,p(CH3COOH)=![]() ×p=
×p=![]() ,熱裂解反應的平衡常數Kp=
,熱裂解反應的平衡常數Kp=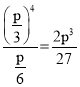 。
。


科目:高中化學 來源: 題型:
【題目】磷酸鐵(FePO4)常用作電極材料、陶瓷及制藥等。以硫鐵礦(主要成分是FeS2及少量SiO2、Fe3O4)為原料制備磷酸鐵的流程如下:
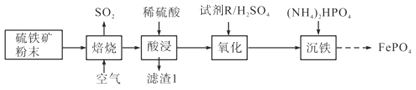
(1)焙燒時FeS2轉化為Fe2O3,該反應中氧化劑與還原劑物質的量之比為___________。
(2)“酸浸”時為加速溶解,采取的措施有_________________________________(任寫兩種)。
(3)濾渣1是___________。
(4)氧化步驟是將少量的Fe2+轉化為Fe3+,試劑R最好選擇___________(填字母)。
A.KMnO4 B.H2O2 C.稀硝酸
(5)寫出沉鐵時反應的離子方程式______________________________________________。
(6)1 t硫鐵礦中含FeS2 a mol、Fe3O4 b mol,按上述流程生成c t的FePO4,則FePO4的產率為__________________。(用含a、b、c的算式表示,不必化簡)
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】W、X、Y、Z四種短周期元素,它們在周期表中位置如圖所示,下列說法不正確的是( )
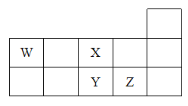
A.Z、Y、W的最高價氧化物的水化物的酸性依次減弱
B.Z、Y、X的原子半徑依次減小,非金屬性依次減弱
C.氣態氫化物的穩定性:H2X>H2Y
D.W的位置是第二周期第ⅣA族
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】已知M是短周期金屬元素,X和Y是短周期非金屬元素,且X、M、Y的原子序數依次增大。三者組成的物質M3XY(可視為M2XMY)是一種良好的離子導體。研究者在常壓下利用下列反應合成M3XY: 2M + 2MXA +2MY==2M3XY +A2。其中常溫常壓下A2是無色無味氣體,已知上述反應中消耗0.92 g M的單質可得到標準狀況下448 mL的A2。下列有關說法正確的是
A.簡單離子半徑:Y>M>X
B.簡單氫化物的沸點:X小于Y
C.MXA是共價化合物
D.M3XY溶于水后溶液呈堿性
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】工業上可利用電解原理間接氧化法降解處理含有機污染物的廢水,其原理如圖所示,下列說法錯誤的是

A.介質離子在電極A上發生氧化反應,電極A為陽極
B.介質離子被氧化得到的強氧化劑可能為Cl2、O2
C.有機污染物在石墨電極上被還原為無污染物質
D.若介質離子為OH-,電極B上發生的反應為2H2O+2e-=H2↑+ 2OH-
查看答案和解析>>
科目:高中化學 來源: 題型:
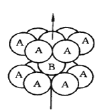
【題目】鈦被稱為繼鐵、鋁之后的第三金屬,請回答下列問題:
(1)基態鈦原子的價層電子排布圖為__________,其原子核外共有______種空間運動狀態不同的電子,金屬鈦的堆積方式如圖所示,為________(填堆積方式)堆積
(2)①已知TiCl4在通常情況下是無色液體,熔點為-37℃,沸點為136℃,均高于結構與其相似的CCl4,主要原因是_______。
②TiCl4可溶于濃鹽酸得H2[TiCl6],向溶液中加入NH4Cl濃溶液可析出黃色的(NH4)2[TiCl6]晶體。該晶體中微觀粒子之間的作用力有______。
A.離子鍵 B.共價鍵 C.分子間作用力 D.氫鍵 E.金屬鍵
(3)硫酸氧鈦晶體中陽離子為鏈狀聚合形式,結構如圖所示,其中Ti-O-Ti在一條直線上。該陽離子化學式為__________,其中O原子的雜化方式為_______。
![]()
(4)2016年7月,研究人員發現了某種鈦金合金的化學式是Ti3Au,它具有生物相容性,是理想的人工髖關節和膝關節;其晶胞結構如圖所示,晶胞參數為a pm,最近的Ti原子距離為![]() ,A原子的坐標參數為(
,A原子的坐標參數為(![]() ,
,![]() ,
,![]() ),則B原子坐標參數為_______,距離Ti原子次近的Ti原子有_______個,Ti-Au間最近距離為_______pm
),則B原子坐標參數為_______,距離Ti原子次近的Ti原子有_______個,Ti-Au間最近距離為_______pm

查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】當電解質中某離子的濃度越大時,其氧化性或還原性越強。利用這一性質,有人設計出如圖所示“濃差電池”(其電動勢取決于物質的濃度差,是由一種物質從高濃度向低濃度轉移而產生的)。實驗開始先斷開K1,閉合K2,發現電流計指針發生偏轉。下列說法錯誤的是
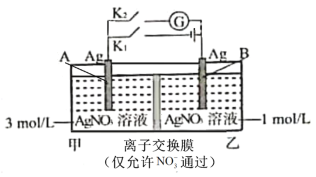
A.斷開K1、閉合K2,一段時間后電流計指針歸零,此時兩池Ag+濃度相等
B.斷開K1、閉合K2,當轉移0.1mol e-時,乙池溶液質量增加17.0 g
C.當電流計指針歸零后,斷開K2、閉合K1,一段時間后B電極的質量增加
D.當電流計指針歸零后,斷開K2、閉合K1,乙池溶液濃度增大
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】已知:還原性HSO—3>I—,氧化性IO—3>I2。在含0.3mol NaHSO3的溶液中逐滴加入KIO3溶液。加入KIO3和析出I2的物質的量的關系曲線如右圖所示。下列說法不正確的是
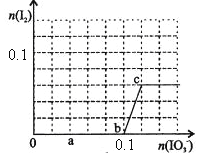
A.0~b間的反應可用如下離子方程式表示:3HSO3-+IO3-=3SO42-+I-+3H+
B.a點時消耗NaHSO3的物質的量為0.12mol
C.當溶液中I—與I2的物質的量之比為5:2時,加入的KIO3為0.18mol
D.b點時的還原產物可能是KI或NaI,b~c間的還原產物是I2
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】可降解聚合物 P 的合成路線如圖:
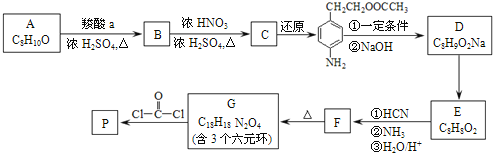
已知: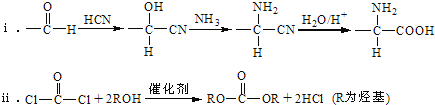 .
.
(1)A的含氧官能團名稱是______。
(2)羧酸a的電離方程式是______。
(3)B→C的化學方程式是______。
(4)化合物D苯環上的一氯代物有2種,D的結構簡式是______。
(5)E→F中反應①和②的反應類型分別是______、______。
(6)F的結構簡式是______。
(7)G→聚合物P的化學方程式是______。
查看答案和解析>>
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com