
在0℃ 1.01×105 Pa下,有關H2、O2、CH4三種氣體的敘述正確的是 ( )
A.其密度之比等于物質的量之比 B.其密度之比等于摩爾質量之比
C.等質量的三種氣體,其體積比等于相對分子質量之比
D.等體積的三種氣體,其物質的量之比等于相對分子質量之比
科目:高中化學 來源: 題型:021
設N0代表阿伏加德羅常數的值, 下列說法正確的是
[ ]
A. 二氧化碳的摩爾質量與N0個二氧化碳分子的質量在數值上相等
B. 常溫常壓下, 活潑金屬從硫酸中置換出11.2L氫氣,發生轉移的電子數為N0
C. 71g由1737Cl原子組成的氯氣所含的電子數為34N0
D. 在0℃, 1.01×105Pa時, 以任意比例混合的N2和NH3的混合物22.4L, 所含的分子數為N0
查看答案和解析>>
科目:高中化學 來源:2011-2012學年安徽省高三上學期第四次模擬考試化學試卷 題型:選擇題
下列各溶液中,物質的量濃度關系正確的是( )
A.在0.1 mol·L-1CH3COONa溶液中,c(OH-)=c(CH3COOH)+c(H+)
B.常溫下,10 mL 0.01 mol·L-1HCl溶液與10 mL 0.01 mol·L-1Ba(OH)2溶液充分混合,若混合后溶液的體積為20 mL,則溶液的pH=12
C.0.1 mol·L-1的KAl(SO4)2溶液中:c(SO42-)>c(Al3+)>c(OH-)>c(H+)
D.等體積、等物質的量濃度的NaX和弱酸HX混合后的溶液,若溶液呈酸性,則有c(Na+)>c(HX)>c(X-)>c(H+)>c(OH-)
查看答案和解析>>
科目:高中化學 來源:2010年吉林省高三上學期第二次摸底考試化學卷 題型:填空題
(12分)某同學用如圖一所示的裝置來探究CO2、SO2與澄清石灰水的反應,結果通入CO2可以看到先渾濁后澄清的現象,但通入SO2沒有能看到渾濁現象。經過思考分析后,該同學改用圖二的裝置,將氣體收集在注射器,緩慢地將氣體一個氣泡一個氣泡地通入澄清石灰水中,都能看到石灰水先變渾濁再澄清的現象,且通入SO2產生現象明顯比通入CO2快。
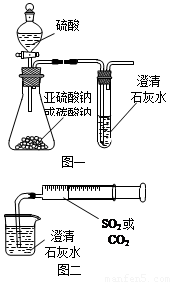
(1)對比分析兩組實驗,你認為用圖一裝置實驗
時,通入SO2不能出現渾濁的原因可能是:
_________________。
(2)用圖二裝置實驗時,以相同速率通入CO2或
SO2,SO2產生渾濁、澄清的現象比CO2
快的原因是______________________________________。
(3)用圖一進行SO2與石灰水反應的實驗時,從安全角度
考慮裝置應做何改進?
_____________________________________________。
(4)有人提出上述實驗現象“石灰水先變渾濁再澄清”可能與澄清石灰水的濃度有關。為了探究CO2通入澄清石灰水中的實驗現象,查得下列數據:
Ⅰ 20℃時,Ca(OH)2 的溶解度為:0.165g/100g水。
Ⅱ 不同濃度石灰水生成CaCO3的最大量
|
飽和石灰水與水的體積比 |
1:0 |
1:1 |
1:2 |
1:3 |
1:5 |
1:7 |
|
能生成CaCO3的最大量(g/100水) |
A |
0.110 |
0.073[來源:Zxxk.Com] |
0.055 |
0.037 |
0.028 |
① 上表中A= g/100g水
Ⅲ 在1.01×105Pa CO2壓力下,CaCO3的溶解度
|
熱力學溫度/K |
282 |
298 |
308 |
|
CaCO3溶解度(g/100水)[來源:學#科#網Z#X#X#K] |
0.130 |
0.094 |
0.076 5 |
Ⅳ 在不同壓強(CO2)下,CaCO3溶解度(18℃)
|
P(CO2)/Pa |
0 |
1.40×104 |
9.95×104 |
|
CaCO3溶解度(g/100水) |
0.001 3 |
0.023 3 |
0.108 6 |
認真分析以上數據回答下列問題:
②由表Ⅲ和表Ⅳ可知CaCO3溶解度的變化規律是:
③由以上數據可以得出結論:欲觀察到“石灰水先變渾濁再澄清的現象”,所需要的實驗條件是:
查看答案和解析>>
科目:高中化學 來源:專項題 題型:填空題
查看答案和解析>>
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com