
【題目】現代煉鋅的方法可分為火法和濕法兩大類。火法煉鋅是將閃鋅礦(主要含ZnS)焙燒使它轉化為氧化鋅,再把氧化鋅和焦炭混合,在鼓風爐中加熱至1100℃~1300℃,使鋅蒸餾出來(設空氣中N2、O2的體積分數分別為0.80、0.20),主要反應為:焙燒爐中:2ZnS(s)+3O2(g) →2ZnO(s)+2SO2(g)①,鼓風爐中:2C(s)+O2(g) →2CO②,鼓風爐中: ZnO(s)+CO(g) ![]() Zn(g)+CO2(g)③。
Zn(g)+CO2(g)③。
(1)已知閃鋅礦中含硫的質量分數為16.0%,而所含雜質不含硫,則閃鋅礦中硫化鋅的質量分數為__。現代工業生產多采用聯合生產,可將閃鋅礦中的硫用于生產硫酸。現有此閃鋅礦100 t,在理論上可生產出98.0%的硫酸___t。
(2)焙燒爐產生的爐氣中SO2的體積分數不超過__%(保留小數點后一位小數,下同)。
(3)鼓風爐容積固定,爐內部分氣態物質其物質的量濃度(mol/L)變化如下:
時間/min | CO | Zn | CO2 |
0 | 0.11 | 0 | 0 |
2 | 0.10 | 0.01 | 0.01 |
3 | 0.01 | 0.10 | 0.10 |
4 | 0.01 | 0.10 | 0.10 |
則鼓風爐中CO總的轉化率為___;若生產中CO總的利用率為95.0%,列式計算每生產1molZn,至少需要補充焦炭多少克___?
(4)若ZnS全部轉化為Zn,焙燒爐出來的N2、O2、SO2混合氣體中N2占82.5%,鼓風爐中CO的轉化率為62.5%,而O2無剩余,試列式計算每生產1molZn,應向焙燒爐和鼓風爐中鼓入新鮮空氣共多少升(S.T.P) ____?
【答案】48.5% 50.0 14.3% 90.9% 12.6 g 459.2 L
【解析】
(1)ZnS中鋅的質量分數ω(S)=![]() ,則:ω(ZnS)×
,則:ω(ZnS)×![]() =16%,故ω(ZnS)=48.5%,設生成98%硫酸為x t,則: S~~~~~~~H2SO4
=16%,故ω(ZnS)=48.5%,設生成98%硫酸為x t,則: S~~~~~~~H2SO4
32 98
100 t×16% x t×98%
所以32:98=(100t×16%):(x t×98%),解得x=50,
故答案為:48.5%;50.0;
(2)假定有2 mol ZnS,最少通入3 mol O2,根據方程式2ZnS(s)+3O2=2ZnO(s)+2SO2(g) 可知,生成的SO2的物質的量為2mol,未參加反應的N2的物質的量為3mol×4=12mol,此時SO2的體積分數為![]() ×100%=14.3%.實際通入的空氣要多,故SO2的體積分數不超過14.3%,
×100%=14.3%.實際通入的空氣要多,故SO2的體積分數不超過14.3%,
故答案為:14.3;
(3)由表可知,3min時反應達平衡,平衡時時CO的平衡濃度為0.01mol/L,所以CO的總轉化率為![]() ×100%=90.9%,令需焦炭質量為m g,實際利用的為95%m g,由方程式可得,關系式ZnO(s)~C(s),所以n(ZnO)=n(C),即
×100%=90.9%,令需焦炭質量為m g,實際利用的為95%m g,由方程式可得,關系式ZnO(s)~C(s),所以n(ZnO)=n(C),即![]() =1,解得m=12.6;
=1,解得m=12.6;
故答案為:90.9%;12.6g;
(4)設焙燒爐中消耗空氣的物質的量為5x,鼓風爐中消耗空氣物質的量為5y,
則:2C+O2===2CO; ZnO(s)+CO(g)====Zn(g)+CO2(g);
y 2y 2y×62.5% 1mol
所以2y×62.5%=1mol,解得 y=0.8mol,所以 5y=4mol
2ZnS+3O2=2ZnO+2SO2 △n
2mol 1mol
1mol 0.5mol
所以4x÷(5x-0.5mol)=82.5%,解得 x=3.3mol,所以 5x=16.5mol,則5x+5y=4mol+16.5mol=20.5mol,V(空氣)=20.5 mol×22.4 Lmol-1=459.2L;
答案:應向焙燒爐和鼓風爐中鼓入新鮮空氣共459.2 L。


 名師指導期末沖刺卷系列答案
名師指導期末沖刺卷系列答案科目:高中化學 來源: 題型:
【題目】有M、A 、B、D、N、E六種短周期元素原子序數依次增大,M元素的單質是自然界最輕的氣體,N元素的原子半徑是所在周期中最大的,A、B、D、E四種元素在周期表中的相應位置如下圖,它們的原子序數之和為37。下列說法不正確的是
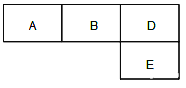
A. 沸點:M2D > BM3 > AM4 B. 原子半徑:rE>rA>rB >rD
C. 化合物AnM2n分子中既含有極性鍵又含有非極性鍵 D. B元素的氫化物與D元素的單質在一定條件下能發生置換反應,且氧化劑與還原劑的物質的量之比為4∶3
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】在恒容密閉容器中,用銅鉻的氧化物作催化劑,用一定量的HCl(g)和O2制取Cl2的原理為:4HCl(g)+O2(g) ![]() 2Cl2(g)+2H2O(g) ΔH<0。下列有關說法不正確的是
2Cl2(g)+2H2O(g) ΔH<0。下列有關說法不正確的是
A. 平衡前,隨著反應的進行,容器內壓強變小
B. 平衡時,其他條件不變,分離出H2O(g),逆反應速率減小
C. 平衡時,其他條件不變,升高溫度平衡常數增大
D. 其他條件不變,使用不同催化劑,HCl(g)的轉化率不變
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】下列反應中,生成物所儲存的化學能比反應物所儲存的化學能多的是
A.2Na2O2 + 2H2O = 4NaOH + O2↑
B.NaOH + HCl = NaCl + H2O
C.CH4 + 2O2 ![]() CO2 + 2H2O
CO2 + 2H2O
D.Ba(OH)2·8H2O + 2NH4Cl = BaCl2 + 2NH3↑ + 10H2O
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】植物在冬季來臨過程中,隨著氣溫的逐漸降低,體內發生了一系列適應低溫的生理生化變化,抗寒力逐漸增強。下圖為冬小麥在不同時期含水量和呼吸速率變化關系圖。請根據圖推斷以下有關說法中,錯誤的是( )
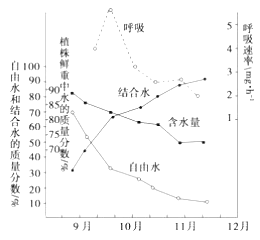
A. 冬季來臨過程中,自由水明顯減少是呼吸速率下降的主要原因
B. 結合水與自由水含量的比值,與植物的抗寒性呈現明顯的正相關
C. 隨著氣溫和土壤溫度的下降,根系的吸水量減少,組織的含水量下降
D. 隨溫度的緩慢降低,植物的呼吸作用逐漸減弱,有利于減少有機物的消耗
查看答案和解析>>
科目:高中化學 來源: 題型:
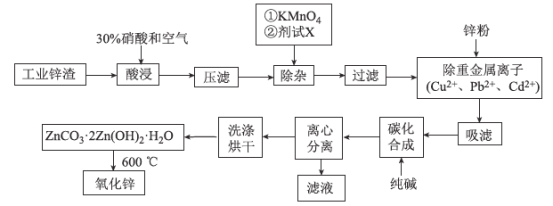
【題目】氧化鋅工業品廣泛應用于橡膠、涂料、陶瓷、化工、醫藥、玻璃和電子等行業,隨著工業的飛速發展,我國對氧化鋅的需求量日益增加,成為國民經濟建設中不可缺少的重要基礎化工原料和新型材料。用工業含鋅廢渣(主要成分為ZnO,還含有鐵、鋁、銅的氧化物,Mn2+、Pb2+、Cd2+等)制取氧化鋅的工藝流程如圖所示:
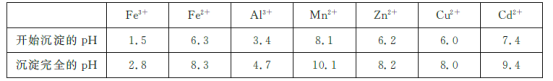
已知:相關金屬離子[c(Mn+)=0.1 mol/L]生成氫氧化物沉淀的pH如下表所示:
回答下列問題:
(1)為保證鋅渣酸浸的充分,先保持酸過量,且c(H+)=0.5 mol/L左右。寫出一種加快鋅渣浸出的方法:_____________________________________
(2)為調節溶液的pH,則試劑X為________(填化學式),且調節溶液pH的范圍是________。
(3)除雜時加入高錳酸鉀的作用是___________,發生反應的離子方程式為_______________。
(4)“過濾”所得濾渣的主要成分是___________ (填化學式)。
(5)寫出“碳化合成”的化學方程式:_________________________________;“碳化合成”過程需純堿稍過量,請設計實驗方案證明純堿過量:_________________________________
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】(1)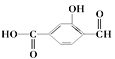 具有官能團分別為:羧基、_______和________(填名稱),
具有官能團分別為:羧基、_______和________(填名稱),
(2)苯酚與溴水生成白色沉淀,發生__________反應;乙烯通入溴水,發生_______反應。(填“加成”或者“取代”)
(3)以下幾組:①白磷和紅磷 ②D和T
③異丁烷 和2,2—二甲基丁烷 ④ CH2 = CH-CH3和![]()
其中互為同系物的是____________;互為同分異構體的是_______________;
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】Ⅰ.根據下列6種符號回答問題:①1H ②2H ③3H ④14C ⑤14N ⑥16O
(1)共有________種核素,屬于________種元素。
(2)互為同位素的是___________。(填序號,下同)
(3)中子數相等的是________________。
Ⅱ.有下列物質:①CO2 ②KCl ③氮氣 ④H2⑤NH4Cl ⑥NaOH ⑦H2SO4試用以上編號填空:
(1)只有非極性鍵的是______________;
(2)只有極性鍵的是__________________;
(3)只有離子鍵的是___________________;
(4)既有離子鍵,又有極性鍵的是___________________;
(5)屬于共價化合物的是___________________。
Ⅲ.寫出下列物質的電子式
(1)N2__________;HClO_________;MgCl2___________;NaOH___________;
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】廢棄物的綜合利用既有利于節約資源,又有利于保護環境。實驗室利用廢舊電池的銅帽(Cu、Zn 總含量約為99%)回收Cu并制備ZnO 的部分實驗過程如下:
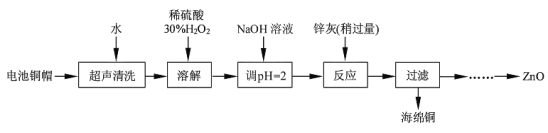
(1)寫出銅帽溶解時銅與加入的稀硫酸、30%H2O2反應的離子反應方程式____;銅帽溶解完全后,需加熱(至沸)將溶液中過量的H2O2除去。
(2)為確定加入鋅灰(主要成分為Zn、ZnO,雜質為鐵及其氧化物)的量,實驗中需測定除去H2O2 后溶液中Cu2+的含量。實驗操作為:準確量取一定體積的含有Cu2+的溶液于帶塞錐形瓶中,加適量水稀釋,調節溶液pH=3~4,加入過量的KI,用Na2S2O3標準溶液滴定至終點。上述過程中反應的離子方程式如下:2Cu2++4I-=2CuI(白色)↓+I2 2S2O32-+I2=2I-+S4O62-
①滴定選用的指示劑為____,滴定終點觀察到的現象為___;
②某同學稱取1.0g電池銅帽進行實驗,得到100.00mL含有Cu2+的溶液,量取20.00mL上述含有Cu2+的溶液于帶塞錐形瓶中,加適量水稀釋,調節溶液pH=3~4,加入過量的KI,用0.1000 mol·L-1Na2S2O3標準溶液滴定至終點。再重復操作實驗3次,記錄數據如下:
實驗編號 | 1 | 2 | 3 | 4 |
V(Na2S2O3)(mL) | 28.32 | 25.31 | 25.30 | 25.32 |
計算電池銅帽中Cu的質量分數為____(結果保留四位有效數字),若滴定前溶液中的H2O2沒有除盡,則所測定c (Cu2+)將會____(填“偏高”、“偏低”或“無影響”);
(3)常溫下,若向50mL 0.0001 mol·L-1CuSO4溶液中加入50mL0.00022 mol·L-1NaOH溶液, 生成了Cu (OH)2沉淀。計算沉淀生成的溶液的pH= ___(假設Cu2+被完全沉淀,混合后溶液體積不發生變化);
(4)已知pH>11 時Zn(OH)2 能溶于NaOH溶液生成[Zn(OH)4]2-。下表列出了幾種離子生成氫氧化物沉淀的pH(開始沉淀的pH 按金屬離子濃度為1.0 mol·L-1計算)。
開始沉淀的pH | 沉淀完全的pH | |
Fe3+ | 1.1 | 3.2 |
Fe2+ | 5.8 | 8.8 |
Zn2+ | 5.9 | 8.9 |
實驗中可選用的試劑:30%H2O2、1.0 mol·L-1HNO3、1.0 mol·L-1NaOH。由除去銅的濾液制備ZnO 的實驗步驟依次為:
①向濾液中加入適量30% H2O2,使其充分反應;
②_______;
③過濾;
④______;
⑤過濾、洗滌、干燥;
⑥900℃煅燒。
查看答案和解析>>
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com