
【題目】有關物質的轉化關系如下圖所示(部分生成物和反應條件已略去)。D、F、G、H均為常見氣體,其中D能使濕潤的紅色石蕊試紙變藍;G呈綠色,H在空氣中含量最高;C的摩爾質量為32g/mol;E為難溶性堿。
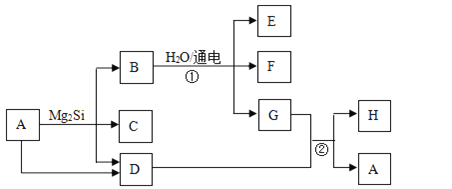
(1)C的化學式為_________。
(2)H的電子式為_________。
(3)寫出反應①的離子方程式: _________。
(4)寫出反應②的化學方程式: _________。
【答案】 SiH4 ![]() Mg2++2Cl-+2H2O
Mg2++2Cl-+2H2O![]() Mg(OH)2+H2+Cl2 8NH3+3Cl2=N2+6NH4Cl
Mg(OH)2+H2+Cl2 8NH3+3Cl2=N2+6NH4Cl
【解析】根據題意分析D、F、G、H均為常見氣體,D能使濕潤的紅色石蕊變藍,說明D是NH3;G為綠色,說明G是氯氣;H在空氣中含量最高,說明H是N2,C的摩爾質量為32g/mol,由轉化關系可以知道應含有Si元素,則C為SiH4,B應為MgCl2,則E為Mg(OH)2,F為H2,A為NH4Cl;
(1)C的化學式為SiH4;
(2)H的電子式為![]() ;
;
(3)反應①為氯化鎂溶液的電解,離子方程式為Mg2++2Cl-+2H2O![]() Mg(OH)2↓+H2↑+Cl2↑
Mg(OH)2↓+H2↑+Cl2↑
(4)反應②為氯氣和氨氣的反應,化學方程式,8NH3+3Cl2=N2+6NH4Cl。


科目:高中化學 來源: 題型:
【題目】化工廠用來檢查氯氣管道是否漏氣的反應為:3Cl2+8NH3→N2+6NH4Cl.
(1)在該反應中,被還原的元素是;作為還原劑的物質是 .
(2)在方程式上標出電子轉移的方向和數目.
(3)若標準狀況下有33.6LCl2參加反應,則被氧化的NH3的物質的量為mol.
(4)已知當氨氣不足量時,反應產物是N2和HCl.若某次反應所得產物中,NH4Cl和HCl的物質的量相等,則參加反應的Cl2和NH3的物質的量之比為 .
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】結合圖回答問題: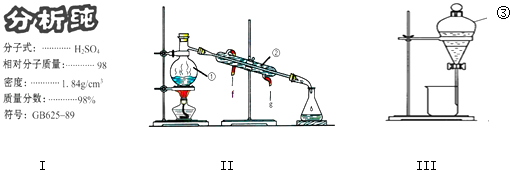
(1)學校實驗室從化學試劑商店買回的硫酸試劑標簽上的部分內容如圖Ⅰ,現欲用此硫酸配制配制成濃度為0.50molL﹣1的稀硫酸100mL.①所需玻璃儀器除燒杯、量筒、玻璃棒、膠頭滴管外還需 .
②所取濃硫酸的體積為mL.
(2)寫出上述裝置Ⅱ中儀器的名稱:②;③;
(3)若利用裝置Ⅱ分離乙酸(沸點118℃)和乙酸乙酯(沸點77.1℃)的混合物,還缺少的儀器有 , 將儀器補充完整后進行的實驗操作的名稱為 .
(4)實驗室常用裝置Ⅲ分離碘水中的碘,該實驗操作名稱為 . 進行該操作時,需在碘水中加一試劑,在選擇試劑時,下列性質你認為哪些性質是必需的:(填序號).①常溫下為液態 ②I2在其中溶解程度大 ③與水互不相容 ④密度要比水大.
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】如圖是某同學設計的制備少量氯氣并進行系列實驗的裝置(夾持及加熱儀器已略).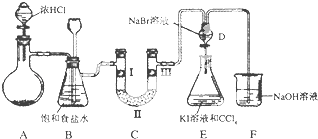
(1)若裝置A中制備氯氣選用的藥品為固體二氧化錳和濃鹽酸,請寫出裝置A中化學反應的離子方程式:;
(2)實驗室也可用高錳酸鉀制氯氣:2KMnO4+16HCl(濃)═5Cl2↑+2MnCl2+2KCl+8H2O①請用雙線橋標出該反應的電子轉移方向和數目.
②該反應中的氧化劑是 , 若消耗0.2mol氧化劑,則被氧化的還原劑的物質的量是 .
(3)裝置C的實驗目的是驗證氯氣是否具有漂白性,為此C中I、Ⅱ、Ⅲ依次放入;(提示:硅膠是干燥劑,不與氯氣反應)
a | b | c | d | |
Ⅰ | 干燥的有色布條 | 干燥的有色布條 | 干燥的有色布條 | 干燥的有色布條 |
Ⅱ | 堿石灰 | 硅膠 | 堿石灰 | 無水氯化鈣 |
Ⅲ | 濕潤的有色布條 | 濕潤的有色布條 | 干燥的有色布條 | 干燥的有色布條 |
(4)設計裝置D、E的目的是比較氯、溴、碘單質的氧化性強弱.當向D中緩緩通入少量氯氣時,D中發生反應的離子方程式為 , 若打開D裝置的活塞,使D中溶液滴入E裝置,振蕩錐形瓶后靜置一會兒,可以觀察到的現象是 .
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】在兩個容積相同的容器中,一個盛有HCl氣體,另一個盛有H2和Cl2的混合氣體.在同溫、同壓下,兩容器內的氣體一定具有相同的是( )
A.原子數
B.相對分子質量
C.質量
D.密度
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】設NA為阿伏加德羅常數的值.下列說法正確的是( )
A.標準狀況下,22.4LCCl4含有C﹣Cl鍵的數目為4NA
B.取50mL 14.0mol/L濃硝酸與足量銅片反應,生成氣體分子的數目為0.35 NA
C.反應NH4N3 ![]() 2N2↑+2H2↑,標準狀況下每生成22.4LN2 , 轉移電子的數目為2 NA
2N2↑+2H2↑,標準狀況下每生成22.4LN2 , 轉移電子的數目為2 NA
D.電解精煉銅時,若轉移的電子數為NA個,則陽極質量減小32g
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】對實驗Ⅰ~Ⅳ的實驗操作現象判斷正確的是( ) 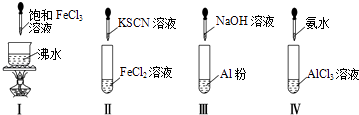
A.實驗Ⅰ:產生紅褐色沉淀
B.實驗Ⅱ:溶液顏色變紅
C.實驗Ⅲ:放出大量氣體
D.實驗Ⅳ:先出現白色沉淀,后溶解
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】已知碳化鋁(Al4C3)與水反應生成氫氧化鋁和甲烷.為了探究甲烷性質,某同學設計如下兩組實驗方案:甲方案探究甲烷與氧化劑反應(如圖1所示);乙方案探究甲烷與氯氣反應的條件(如圖2所示). 
甲方案實驗現象:溴水無顏色變化,無水硫酸銅變藍色,澄清石灰水變渾濁.
乙方案實驗操作過程:通過排飽和食鹽水的方法收集兩瓶甲烷與氯氣(體積比為1:4)的混合氣體,I瓶放在光亮處,II瓶用預先準備好的黑色紙套套上,按圖2安裝好裝置,并加緊彈簧夾a和b.
(1)碳化鋁與稀硫酸反應的化學方程式為 .
(2)寫出甲方案實驗中硬質試管里可能發生的化學方程式 , (實驗測得消耗甲烷與氧化銅物質的量之比2:7)
(3)實驗甲中濃硫酸的作用是 , 集氣瓶中收集到的氣體(填“能”或“不能”)直接排入空氣中?
(4)下列對甲方案實驗中的有關現象與結論的敘述都正確的是
A.酸性高錳酸鉀溶液不褪色,結論是通常條件下,甲烷不能與強氧化劑反應
B.硬質試管里黑色粉末變紅色,說明氧化銅發生了氧化反應
C.硬質試管里黑色粉末變紅色,推斷氧化銅與甲烷反應只生成水和二氧化碳
D.甲烷不能與溴水反應,推知甲烷不能與鹵素單質反應
(5)乙方案中燒杯里放入足量的水,打開彈簧夾a、b,一段時間后,觀察到有水倒吸到I瓶中,但水并不能充滿I瓶,請寫出該實驗現象所涉及的一個化學方程式 . 除了上述現象外,該實驗中還可能觀察到的現象有(填序號).
A.I瓶中氣體顏色變淺 B.I瓶中出現白霧
C.I瓶瓶內壁出現油狀物質 D.II瓶中與I瓶現象相同.
查看答案和解析>>
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com