
工業上用CO來生產燃料甲醇。一定條件下發生反應:CO(g)+2H2(g)![]() CH3OH(g)。圖1表示反應過程中能量的變化情況;圖2表示一定溫度下,向固定體積為2 L的容器中加入4 mol H2和一定量的CO后,CO(g)和CH3OH(g)的物質的量
CH3OH(g)。圖1表示反應過程中能量的變化情況;圖2表示一定溫度下,向固定體積為2 L的容器中加入4 mol H2和一定量的CO后,CO(g)和CH3OH(g)的物質的量


請回答下列問題:
(1)在圖1中,曲線________(填“a”或“b”)表示反應使用了催化劑;該反應屬于________(填“吸熱”或“放熱”)反應。
(2)根據圖2判斷下列說法中正確的是________(填序號)。ks5u
a.起始充入的CO的物質的量為2 mol b.增大CO的濃度,CO的轉化率增大
c.容器中壓強恒定時,說明反應已達平衡狀態
d.保持溫度和密閉容器的容積不變,再充入1 mol CO和2 mol H2,再次達到平衡時,n(CH3OH)/n(CO)的值會變小。
(3)從反應開始至達到平衡,v(H2)=________。該溫度下CO(g)+2H2(g) ![]() CH3OH(g)的化學平衡常數為________;若保持其他條件不變,將反應體系升溫,則該反應的化學平衡常數將________(填“增大”“減小”或“不變”)。
CH3OH(g)的化學平衡常數為________;若保持其他條件不變,將反應體系升溫,則該反應的化學平衡常數將________(填“增大”“減小”或“不變”)。
(4)已知CH3OH(g)+![]() O2(g)===CO2(g)+2H2O(g) ΔH=-192.9 kJ·mol-1,H2O(l)===H2O(g) ΔH=+44 kJ·mol-1,請寫出32 g CH3OH(g)完全燃燒生成CO2和液態水的熱化學方程式:___________________。
O2(g)===CO2(g)+2H2O(g) ΔH=-192.9 kJ·mol-1,H2O(l)===H2O(g) ΔH=+44 kJ·mol-1,請寫出32 g CH3OH(g)完全燃燒生成CO2和液態水的熱化學方程式:___________________。
科目:高中化學 來源: 題型:閱讀理解
 (2013?臨沂三模)工業上“固定”和利用CO2能有效地減輕“溫室效應”.
(2013?臨沂三模)工業上“固定”和利用CO2能有效地減輕“溫室效應”.| 物質的化學式 | CH3COOH | H2CO3 | |
| 電離平衡常數 | K=1.8×10-5 | K1=4.3×10-7 | K2=5.6×10-11 |
| c(CH3COO-) |
| c(CH3COOH) |
查看答案和解析>>
科目:高中化學 來源:2012-2013學年山東省文登市高三3月模擬考試化學試卷(解析版) 題型:填空題
近年來,碳和碳的化合物在生產生活實際中應用廣泛。
(1)在2升的密閉容器中,充有2mol CO與4mol 水蒸氣,在催化劑作用下進行如下化學反應:CO(g)+H2O(g) CO2(g)+H2(g),CO的轉化率和溫度t的關系如下表:
CO2(g)+H2(g),CO的轉化率和溫度t的關系如下表:
|
t(℃) |
750 |
850 |
1000 |
|
CO% |
0.7 |
2/3 |
0.5 |
1000℃時該反應的平衡常數為___________________。850℃時,向該容器中重新通入1mol CO、1.5mol H2O、0.5mol CO2和2molH2,此時反應___________(填“向右進行”、“向左進行”或“處于平衡狀態”)。
(2)已知:C(s)+O2 (g) ===CO2(g) △H1=﹣393.5kJ·mol-1
2H2(g)+O2(g)=== 2H2O(g) △H2=﹣483.6kJ·mol-1
C(s)+H2O(g)=== CO(g)+H2(g) △H3=+131.3kJ·mol-1
則CO和H2O生成CO2和H2的熱化學方程式為_______________________________。
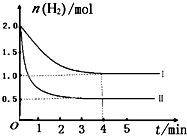
(3) 目前工業上可用CO2來生產燃料甲醇,有關反應為:
CO2(g)+3H2(g) CH3OH(g)+H2O(g) ΔH=-49.0 kJ·mol-1。現向體積為1 L的密閉容器中,充入
CH3OH(g)+H2O(g) ΔH=-49.0 kJ·mol-1。現向體積為1 L的密閉容器中,充入
1mol CO2和3mol H2,反應過程中測得CO2和CH3OH(g)的濃度隨時間的變化如圖所示。

①從反應開始到平衡,氫氣的平均反應速率v(H2)=_____________;
②若改變條件使平衡向正反應方向移動,則平衡常數______________(填序號)
a.可能不變 b.可能減小 c.可能增大 d.不變、減小、增大皆有可能
(4)NaHCO3的水溶液呈堿性,其原因是(用文字敘述)_______________________。常溫下,向100mL
0.2mol/LNaHCO3溶液中滴加amol/L的醋酸溶液,當滴加到溶液呈中性時,所用去的醋酸體積剛好也
為100mL,此時醋酸的電離常數為b, 用含b的代數式表示醋酸的濃度a=_____________________。
查看答案和解析>>
科目:高中化學 來源:臨沂三模 題型:問答題
| 物質的化學式 | CH3COOH | H2CO3 | |
| 電離平衡常數 | K=1.8×10-5 | K1=4.3×10-7 | K2=5.6×10-11 |
| c(CH3COO-) |
| c(CH3COOH) |
查看答案和解析>>
科目:高中化學 來源:2013年山東省臨沂市高考化學三模試卷(解析版) 題型:解答題
| 物質的化學式 | CH3COOH | H2CO3 | |
| 電離平衡常數 | K=1.8×10-5 | K1=4.3×10-7 | K2=5.6×10-11 |
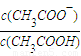 =______.
=______.
查看答案和解析>>
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com