
【題目】(1)![]() 世紀
世紀![]() 年代,
年代,![]() 和
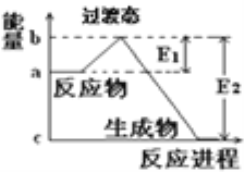
和![]() 在碰撞理論的基礎上提出化學反應的過渡態理論:化學反應并不是通過簡單的碰撞就能完成的,而是在反應物到生成物的過程中經過一個高能量的過渡態.如圖是
在碰撞理論的基礎上提出化學反應的過渡態理論:化學反應并不是通過簡單的碰撞就能完成的,而是在反應物到生成物的過程中經過一個高能量的過渡態.如圖是![]() 和
和![]() 反應生成
反應生成![]() 和
和![]() 過程中的能量變化示意圖,說明這個反應是________(填“吸熱”或“放熱”)反應,
過程中的能量變化示意圖,說明這個反應是________(填“吸熱”或“放熱”)反應,![]() 和
和![]() 的總能量________(填“
的總能量________(填“![]() ”、“
”、“![]() ”或“
”或“![]() ”)
”)![]() 和
和![]() 的總能量.
的總能量.
(2)在某體積為![]() 的密閉容器中充入
的密閉容器中充入![]() 和
和![]() ,在一定條件下發生反應:
,在一定條件下發生反應:![]()
![]()
![]() ,
,![]() 時,測得容器中
時,測得容器中![]() 的物質的量為
的物質的量為![]() ,則:
,則:
①該段時間內,用![]() 表示的平均反應速率為________.
表示的平均反應速率為________.
②假設此反應在![]() 時達到平衡,則此時容器內氣體的總物質的量為________.
時達到平衡,則此時容器內氣體的總物質的量為________.
③下列事實能夠說明上述反應在該條件下已經達到化學平衡狀態的是________
A.容器內氣體的質量保持變
B.NO2的物質的量濃度不再改變
C.容器內氣體的平均相對分子質量不變
D.NO2的消耗速率與![]() 的消耗速率相等
的消耗速率相等
E.容器內氣體的物質的量保持不變.
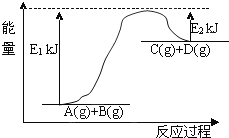
(3)已知某反應A(g)+B(g)C(g)+D(g)過程中的能量變化如圖所示,回答下列問題:
該反應是________反應,該反應的△H=________,1mol氣體A和1mol氣體B具有的總能量比1mol氣體C和1mol氣體D具有的總能量________.
【答案】放熱 > 0.05mol/(L.min) 1.5mol BD 吸熱 (E1E2)KJ/mol 低
【解析】
(1)當反應物的總能量高于生成物的總能量時,反應為放熱反應;
(2)①根據公式v=![]() 進行計算;
進行計算;
②反應是一個前后體積不變的反應,所以反應后容器內氣體的總物質的量=反應前的氣體的總物質的量;
③當化學反應達到平衡狀態時,正逆反應速率相等,各物質的濃度不再發生變化,根據平均相對分子質量的公式進行分析;
(3)根據反應物總能量和生成物總能量的關系判斷反應熱。
(1)當反應物的總能量高于生成物的總能量時,反應為放熱反應;
(2)① NO2(g) + CO(g)![]() CO2(g)+NO(g)
CO2(g)+NO(g)
初始濃度: 0.25 0.25 0 0
變化濃度: 0.1 0.1 0.1 0.1
2min時濃度:0.15 0.15 0.1 0.1
用CO2表示的平均反應速率v=![]() =
=![]() =0.05molL-1min-1;
=0.05molL-1min-1;
②反應是一個前后體積不變的反應,所以反應在5min時達到平衡,則此時容器內氣體的總物質的量=反應前的氣體的總物質的量=1.5mol;
③A.容器內的氣體反應前后遵循質量守恒,容器內氣體的質量保持不變,不一定是平衡狀態,故A錯誤;
B.NO2的物質的量濃度不再改變是平衡狀態,故B正確;
C.容器內氣體的平均相對分子質量在數值上=![]() ,始終是一個不變量,所以容器內氣體的平均相對分子質量不變時,不一定是平衡狀態,故C錯誤;
,始終是一個不變量,所以容器內氣體的平均相對分子質量不變時,不一定是平衡狀態,故C錯誤;
D.NO2的消耗速率與CO2的消耗速率相等,說明正逆反應速率相等,是平衡狀態,故D正確;
E.反應是一個前后體積不變的反應,容器內氣體的物質的量保持不變,不一定是平衡狀態,故E錯誤;
故答案為BD;
(3)反應物總能量大于生成物總能量,反應后能量升高,所以是吸熱反應;反應熱=反應物總能量-生成物總能量,即△H=E1-E2;1mol氣體A和1mol氣體B具有的總能量比1mol氣體C和1mol氣體D具有的總能量一定低。


科目:高中化學 來源: 題型:
【題目】接觸法制硫酸工藝中,其主反應如下:
2SO2(g) + O2(g) ![]() 2SO3(g)
2SO3(g) ![]() H=-197 kJ/mol
H=-197 kJ/mol
下列說法正確的是
A. 因為反應放熱,所以該反應不需要加熱即能快速反應
B. 增大O2的濃度可以提高反應速率和SO2的轉化率
C. 反應450℃時的平衡常數小于500℃時的平衡常數
D. 恒溫下縮小容器容積,使Q > K
查看答案和解析>>
科目:高中化學 來源: 題型:
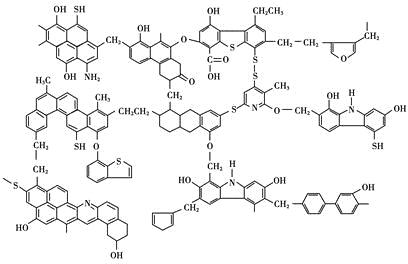
【題目】已知煤的近代結構模型如圖所示。
回答下列問題:
(1)從煤的結構模型來看,煤是工業上獲得____________的重要來源。
(2)我國大約70%的煤是直接用于燃燒的。從煤的結構模型來看,在提供熱量的同時產生大量的____________、____________等氣體物質,造成嚴重的大氣污染。
(3)“型煤”技術不僅可以減少87%的廢氣排放量,煙塵排放量也可減少80%,致癌物苯并[α]芘的排放量也減少,同時節煤20%~30%。“型煤”技術的原理是利用固硫劑在燃燒過程中生成穩定的硫酸鹽。某“型煤”生產廠利用石灰石作固硫劑,試用化學方程式表示其固硫過程________________、________________。
(4)為了解決煤燃燒所造成的污染問題和提高煤的利用價值,煤資源的綜合利用方法還有____________、____________、____________等。
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】下列敘述中正確的是
A. 稀醋酸與稀氫氧化鈉溶液發生中和反應的熱化學方程式為CH3COOH (aq) + NaOH (aq) = CH3COONa(aq) + H2O(l) ΔH=![]() 57.3kJ/mol
57.3kJ/mol
B. 在101kPa時1mol物質燃燒時的反應熱叫做該物質的燃燒熱
C. 未來氫氣作為新能源的其中一個優點是充分燃燒的產物不污染環境
D. 升高溫度或加入催化劑,可以改變化學反應的反應熱
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】在一恒溫恒容的密閉容器中,放入一定量的甲醇,發生反應:![]() .以下可以作為該反應達到平衡狀態的判斷依據為( )
.以下可以作為該反應達到平衡狀態的判斷依據為( )
A.容器內氣體密度保持不變B.氣體的平均相對分子質量保持不變
C.![]() 的體積分數保持不變D.
的體積分數保持不變D.![]() 與
與![]() 的物質的量之比保持
的物質的量之比保持![]() 不變
不變
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】短周期主族元素W、X、Y、Z的原子序數逐漸增大,四種元素形成的化合物甲的結構如圖所示。且W與X、Y、Z均可形成電子數相等的分子,![]() 常溫常壓下為液體。下列說法不正確的是( )
常溫常壓下為液體。下列說法不正確的是( )
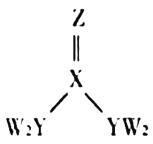
A.X、Y的簡單氫化物的穩定性:![]()
B.W、Y、Z三種元素不能形成離子化合物
C.![]() 甲分子中存在
甲分子中存在![]() 鍵
鍵
D.Y元素的簡單氫化物能使濕潤的紅色石蕊試紙變藍
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】我國科學家研發了一種室溫下“可呼吸”的Na—CO2二次電池。將NaClO4溶于有機溶劑作為電解液,鈉和負載碳納米管的鎳網分別作為電極材料,電池的總反應為:3CO2+4Na![]() 2Na2CO3+C。下列說法錯誤的是
2Na2CO3+C。下列說法錯誤的是

A. 放電時,ClO4-向負極移動
B. 充電時釋放CO2,放電時吸收CO2
C. 放電時,正極反應為:3CO2+4e =2CO32-+C
D. 充電時,正極反應為:Na++e=Na
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】Ⅰ.在![]() 密閉容器中放入
密閉容器中放入![]() ,在一定溫度進行如下反應:
,在一定溫度進行如下反應:![]()
容器內氣體總壓強(P)與起始壓強![]() 的比值隨反應時間(t)數據見下表:(提示,密閉容器中的壓強比等于氣體物質的量之比)
的比值隨反應時間(t)數據見下表:(提示,密閉容器中的壓強比等于氣體物質的量之比)
時間 | 0 | 1 | 2 | 4 | 8 | 16 | 20 | 25 | |
| 1.00 | 1.50 | 1.80 | 2.20 | 2.30 | 2.38 | 2.40 | 2.40 |
回答下列問題
(1)下列能提高A的轉化率的是_______
A.升高溫度 B.體系中通入A氣體
C.將D的濃度減小 D.通入稀有氣體![]() ,使體系壓強增大到原的5倍
,使體系壓強增大到原的5倍
(2)該反應的平衡常數的表達式K_______,前2小時C的反應速率是_________![]() ;
;
(3)平衡時A的轉化率___________,C的體積分數__________(均保留兩位有效數字)
(4)相同條件下,若該反應從逆向開始,建立與上述相同的化學平衡,則D的物質的量取值范圍![]() ______
______![]()
Ⅱ.已知乙酸是一種重要的化工原料,該反應所用的原理與工業合成乙酸的原理類似;常溫下,將![]() 溶于水配成
溶于水配成![]() 溶液,向其中滴加等體積的
溶液,向其中滴加等體積的![]() 的鹽酸使溶液呈中性(不考慮醋酸和鹽酸的揮發),用含a和b的代數式表示醋酸的電離常數
的鹽酸使溶液呈中性(不考慮醋酸和鹽酸的揮發),用含a和b的代數式表示醋酸的電離常數![]() ___________
___________
查看答案和解析>>
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com