
某火電廠的脫硫尾氣通入飽和K2CO3溶液吸收池后,經分解池制得純凈的CO2,再在合成塔與H2反應生成甲醇。其工藝藝流程示意圖如下:
(1)吸收池中飽和K2CO3溶液吸收CO2的離子方程式是 。
(2)流程示意圖中循環使用的物質是 。
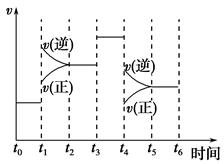
(3)300℃時,合成塔中的反應為CO2(g)+3H2(g) CH3OH(g)+H2O(g),在密閉條件下,下列示意圖能說明反應進行到t1時刻時達到平衡狀態的是 (填字母序號)
CH3OH(g)+H2O(g),在密閉條件下,下列示意圖能說明反應進行到t1時刻時達到平衡狀態的是 (填字母序號)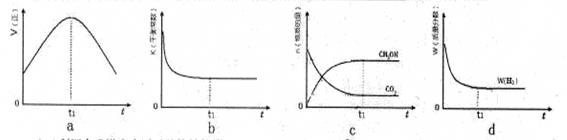
(4)利用合成塔中失活后的鉻鋅觸媒可制得含有Cl- 和CrO42- 的溶液,其濃度均為0.01mol/L,向該溶液中逐滴加入0.01mol/L的AgNO3溶液時,首先產生沉淀的陰離子是 (已知:Ksp(AgCl)=1.56×10-10,Ksp(Ag2CrO4)=9.0×10-12)
(5)合成塔中失活的鉻鋅觸媒可用于制備鋅錳電池。在堿性條件下,該電池的總反應為:Zn(s) +2MnO2(s) +H2O(l) = Zn(OH)2(s) +Mn2O3(s) ,該電池正極的電極反應式是 。若用電池電解(惰性電極)足量的Mg(NO3)2和NaCl的混合溶液,電解過程中陰極的現象是 。
(1)CO2+CO32-+H2O=2HCO3-
(2)K2CO3
(3)cd
(4)Cl-
(5)2MnO2+2e-+H2O=2OH-+Mn2O3 有無色氣體和白色沉淀產生
解析試題分析:(1)K2CO3溶液的吸收CO2生成KHCO3,將K+刪除寫成離子方程式。
(2)KHCO3受熱分解又得到K2CO3,這是循環物質;
(3)反應達到平衡狀態又兩個特征:一是v(正)= v(逆);二是各物質組分含量不變。a圖像沒有說明逆反應的速率,不能確定;b是反應得到平衡的常數K,與反應是否達到平衡無關,與溫度有關,b不能判斷平衡與否;c中的CH3OH和CO2的物質的量不變,即組分不變,說明得到平衡狀態;d是H2的含量分數不變,也是組分恒定,說明得到平衡狀態。
(4)0.01mol/L Cl-,開始沉淀時c(Ag+)=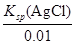 =1.56×10-8;0.01mol/L CrO42-,開始沉淀時c(Ag+)=
=1.56×10-8;0.01mol/L CrO42-,開始沉淀時c(Ag+)=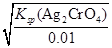 =3.0×10-5。故Cl-先沉淀。
=3.0×10-5。故Cl-先沉淀。
(5)氧化劑MnO2做正極材料,得電子,生成Mn2O3,注意環境,故生成OH-。電解(惰性電極)足量的Mg(NO3)2和NaCl的混合溶液,根據放電順序,陽極Cl-放電,陰極水電離的H+放電,產生OH-,與Mg2+結合生成Mg(OH) 2白色沉淀。
考點:化學流程為載體,考查化學平衡圖像、難溶物的Ksp計算及電化學反應原理。


科目:高中化學 來源: 題型:填空題
溴及其化合物廣泛應用于醫藥、農藥、纖維、塑料組燃劑等,回答下列問題:
(1)海水提溴過程中,向濃縮的海水中通入 ,將其中的Br - 氧化,再用空氣吹出溴;然后用碳酸鈉溶液吸收溴,溴歧化為Br-和BrO3-,其離子方程式為 。
(2)溴與氯能以共價鍵結合形成BrCl。BrCl分子中, 顯正電性。BrCl與水發生反應的化學方程式為 。
(3)CuBr2分解的熱化學方程式為:
2CuBr2(s)="2CuBr(s)+" Br2(g) △H=+105.4kJ/mol-1
在密閉容器中將過量CuBr2于487K下加熱分解,平衡時p(Br2)為4.66×103Pa。
①如反應體系的體積不變,提高反應溫度,則p(Br2)將會 (填“增大”、“不變”或“減小”)。
②如反應溫度不變,將反應體系的體積增加一倍,則p(Br2)的變化范圍為 。
查看答案和解析>>
科目:高中化學 來源: 題型:填空題
鎳具有優良的物理和化學特性,是許多領域尤其是高技術產業的重要原料。羰基法提純粗鎳涉及的兩步反應依次為:
反應Ⅰ Ni(S)+4CO(g)
 Ni(CO)4(g)△H1<0
Ni(CO)4(g)△H1<0
反應Ⅱ Ni(CO)4(g)  Ni(S)+4CO(g) △H2
Ni(S)+4CO(g) △H2
(1)在溫度不變的情況下,要提高反應Ⅰ中Ni(CO)4的產率,可采取的措施有 、 。
(2)已知350K下的2L密閉容器中裝有100g粗鎳(純度98.5%,所含雜質不與CO反應),通入6 molCO氣體發生反應Ⅰ制備Ni(CO)4,容器內剩余固體質量和反應時間的關系如圖所示,10min后剩余固體質量不再變化。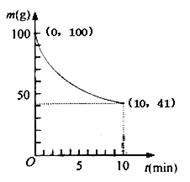
①反應Ⅰ在0~10min的平均反應速率v(Ni(CO)4)= 。
②若10min達到平衡時在右端得到29.5g純鎳,則反應Ⅰ的平衡常數K1為多少?(寫出計算過程)
(3)反應Ⅱ中 △H2 0(填“>”、“<”、“=”);若反應Ⅱ達到平衡后,保持其他條件不變,降低溫度,重新達到平衡時 。(雙選)
a.平衡常數K增大 b.CO的濃度減小 c.Ni的質量減小 d.v逆[Ni(CO)4]增大
(4)用吸收H2后的稀土儲氫合金作為電池負極材料(用MH)表示),NiO(OH)作為電池正極材料,KOH溶液作為電解質溶液,可制得高容量,長壽命的鎳氫電池。電池充放電時的總反應為:
NiO(OH)+MH Ni(OH)2+M 電池充電時,陽極的電極反應式為 。電池充電時陰極上發生 (填“氧化”或“還原”)反應
Ni(OH)2+M 電池充電時,陽極的電極反應式為 。電池充電時陰極上發生 (填“氧化”或“還原”)反應
查看答案和解析>>
科目:高中化學 來源: 題型:填空題
在2 L密閉容器中進行反應:mX(g)+nY(g) pZ(g)+qQ(g),式中m、n、p、q為化學計量數。在0~3 min內,各物質物質的量的變化如下表所示:
pZ(g)+qQ(g),式中m、n、p、q為化學計量數。在0~3 min內,各物質物質的量的變化如下表所示:
| 物質 時間 | X | Y | Z | Q |
| 起始/mol | 0.7 | | 1 | |
| 2 min末/mol | 0.8 | 2.7 | 0.8 | 2.7 |
| 3 min末/mol | | | 0.8 | |
查看答案和解析>>
科目:高中化學 來源: 題型:填空題
甲醇被稱為21世紀的新型燃料,工業上通過下列反應Ⅰ和Ⅱ,用CH4和H2O為原料來制備甲醇。
(1)將1.0 mol CH4和2.0 mol H2O(g)通入反應室(容積為100 L),在一定條件下發生反應:CH4(g)+H2O(g) CO(g)+3H2(g)……Ⅰ,CH4的轉化率與溫度、壓強的關系如圖所示。
CO(g)+3H2(g)……Ⅰ,CH4的轉化率與溫度、壓強的關系如圖所示。
①已知100°C時達到平衡所需的時間為5 min,則用H2表示的平均反應速率為________。
②圖中的p1________p2(填“<”“>”或“=”),100°C時平衡常數為________。
③在其他條件不變的情況下降低溫度,逆反應速率將________(填“增大”“減小”或“不變”)。
(2)在壓強為0.1 MPa條件下,a mol CO與3a mol H2的混合氣體在催化劑作用下能自發反應生成甲醇:CO(g)+2H2(g) CH3OH(g)……Ⅱ。
CH3OH(g)……Ⅱ。
④該反應的ΔH________0,ΔS________0(填“<”“>”或“=”)。
⑤若容器容積不變,下列措施可增加甲醇產率的是________。
A.升高溫度
B.將CH3OH(g)從體系中分離
C.充入He,使體系總壓強增大
D.再充入1 mol CO和3 mol H2
⑥為了尋找合成甲醇的溫度和壓強的適宜條件,某同學設計了三組實驗,部分實驗條件已經填在下面實驗設計表中。請在下表空格中填入剩余的實驗條件數據。
| 實驗編號 | T(°C) | n(CO)/n(H2) | p(MPa) |
| ⅰ | 150 | ½ | 0.1 |
| ⅱ | ________ | ________ | 5 |
| ⅲ | 350 | ________ | 5 |
查看答案和解析>>
科目:高中化學 來源: 題型:填空題
哈伯因發明了由氮氣和氫氣合成氨氣的方法而獲得1918年諾貝爾化學獎。現將氫氣和氮氣充入某密閉容器中,在一定條件下反應的有關數據為:
| 項目 | H2 | N2 | NH3 |
| 起始時 | 5 mol·L-1 | 3 mol·L-1 | 0 |
| 2 s末 | 2 mol·L-1 | | |
查看答案和解析>>
科目:高中化學 來源: 題型:填空題
300°C時,將2 mol A和2 mol B兩種氣體混合于2 L密閉容器中,發生如下反應:3A(g)+B(g) 2C(g)+2D(g) ΔH=Q,2 min末達到平衡,生成0.8 mol D。
2C(g)+2D(g) ΔH=Q,2 min末達到平衡,生成0.8 mol D。
(1)300°C時,該反應的平衡常數表達式為K=________。已知K300°C<K350°C,則ΔH________0(填“>”或“<”)。
(2)在2 min末時,B的平衡濃度為_______,D的平均反應速率為_______。
(3)若溫度不變,縮小容器容積,則A的轉化率________(填“增大”“減小”或“不變”),原因是__________________________________________。
(4)如果在相同的條件下,上述反應從逆反應方向進行,開始時若加入C、D各 mol。若使平衡時各物質的物質的量濃度與原平衡相同,則還應該加入B________mol。
mol。若使平衡時各物質的物質的量濃度與原平衡相同,則還應該加入B________mol。
查看答案和解析>>
科目:高中化學 來源: 題型:填空題
(1)在固定體積的密閉容器中通入N2和H2,下列能說明達到平衡的是________。
| A.3v(N2)=v(H2) |
| B.斷裂1個N≡N的同時斷裂6個N—H |
| C.N2、H2、NH3的物質的量之比是1∶3∶2 |
| D.容器內氣體的壓強不變 |
查看答案和解析>>
科目:高中化學 來源: 題型:填空題
水煤氣是一種高效氣體燃料,其主要成分是CO和H2,可用水蒸氣通過熾熱的碳制得:C (s)+H2O(g) CO (g)+H2 (g) ΔH="+131" kJ·mol-1
CO (g)+H2 (g) ΔH="+131" kJ·mol-1
(1)T溫度下,四個容器中均進行著上述反應,各容器中碳足量,其他物質的物質的量濃度及正、逆反應速率關系如下表所示。請填寫表中相應的空格。
| 容器 編號 | c(H2O) /mol·L-1 | c(CO) /mol·L-1 | c(H2) /mol·L-1 | v正、v逆比較 |
| Ⅰ | 0.06 | 0.60 | 0.10 | v正=v逆 |
| Ⅱ | 0.06 | 0.50 | 0.40 | ① |
| Ⅲ | 0.12 | 0.40 | 0.80 | v正<v逆 |
| Ⅳ | 0.12 | 0.30 | ② | v正=v逆 |
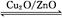 CH3OH(g) ΔH>0,給合成甲醇反應體系中通入少量CO則平衡 移動,減小壓強則平衡 移動,降低溫度則平衡 移動(填“向左”、“向右”或“不”)。
CH3OH(g) ΔH>0,給合成甲醇反應體系中通入少量CO則平衡 移動,減小壓強則平衡 移動,降低溫度則平衡 移動(填“向左”、“向右”或“不”)。 查看答案和解析>>
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com