
【題目】乙烯與甲苯都是重要的有機化工原料.
(1)乙烯通入到Br2水中,現象是_____________.
(2)由甲苯獲取食品香料添加劑苯甲酸苯甲酯,存在下列轉化:
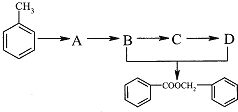
回答下列問題:
①C中的官能團名稱____________,C→D的反應類型________________.
②B→C的化學方程式為________________.
③B+D→ ![]() 的化學方程式為_____________________.
的化學方程式為_____________________.
④A的化學式為C7H7Cl,則含有苯環的A的同分異構體還有______________種.
科目:高中化學 來源: 題型:
【題目】I.標準狀態下,氣態分子斷開1 mol化學鍵的焓變稱為鍵焓。已知H—H、H—O和O=O鍵的鍵焓分別為436 kJ·mol-1、463 kJ·mol-1和495 kJ·mol-1,請寫出水蒸氣分解的熱化學方程式__________。
II.甲醇(CH3OH)廣泛用作燃料電池的燃料,可由CO和H2來合成,化學方程式為CO(g)+2H2(g)![]() CH3OH(g)。
CH3OH(g)。
(1)下圖是反應CO(g)+2H2(g)![]() CH3OH(g)在不同溫度下CO的轉化率隨時間變化的曲線。
CH3OH(g)在不同溫度下CO的轉化率隨時間變化的曲線。
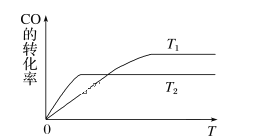
①T1____T2(填“>”“<”或“=”)。T1和T2溫度下的平衡常數大小關系是K1____(填“>”“<”或“=”)K2。
②若容器容積不變,下列措施不能增加CO轉化率的是______(填字母)。
a. 降低溫度 b. 將CH3OH(g)從體系中分離
c. 使用合適的催化劑 d. 充入He,使體系總壓強增大
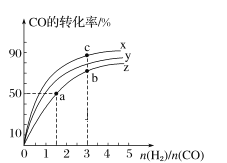
(2)在容積為1 L的恒容容器中,分別研究在300 ℃、350 ℃和370 ℃三種溫度下合成甲醇的規律。如圖是上述三種溫度下H2和CO的起始組成比(起始時CO的物質的量均為1 mol)與CO平衡轉化率的關系,則曲線x對應的溫度是______℃;曲線z對應的溫度下上述反應的化學平衡常數為______。曲線上a、b、c點對應的化學平衡常數分別為K1、K2、K3,則K1、K2、K3的大小關系為___________。
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】將2mol·L-1A氣體和1mol·L-1B氣體混合,并在一定條件下發生反應:2A(g)+B(g)![]() 2C(g),若經2s后測得C的濃度為0.6mol·L-1,現有下列幾種說法:
2C(g),若經2s后測得C的濃度為0.6mol·L-1,現有下列幾種說法:
①用物質B表示的反應的平均速率為0.6mol·L-1·s-1
②用物質A表示的反應的平均速率為0.3mol·L-1·s-1
③2s時物質A的轉化率為70%
④2s時物質B的濃度為0.7mol·L-1
其中正確的是( )
A.① ③B.③ ④C.② ③D.② ④
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】在建國70周年閱兵儀式上,“殲20”“東風-41 核導彈”等國之重器亮相,它們采用了大量合金材料。回答下列問題:
(1)查閱資料顯示第二電離能 Cu 大于 Zn,理由是 _____________。
(2)鈦鎳合金可用于戰斗機的油壓系統,該合金溶于熱的硫酸生成 Ti(SO4)2、NiSO4,其中陰離子的立體構型為______,S的_____雜化軌道與O的2p軌道形成______鍵(填“π”或“σ”)。
(3)鐵元素能與 CO 形成 Fe(CO)5。羰基鐵[Fe(CO)5]可用作催化劑、汽油抗爆劑等。1molFe(CO)5分子中含___molσ鍵,與CO互為等電子體的一種離子的化學式為____。
(4)金屬鈦采用六方最密堆積的方式形成晶體,其晶胞的俯視圖為__(填字母序號)。
A.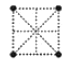 B.
B.  C.
C.  D .
D .
a. 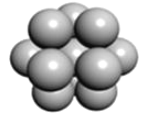 b.
b.  c.
c. 
(5) 鎂單質晶體中原子的堆積模型如圖,它的堆積模型名稱為__;晶胞是圖中的_(填 a、b 或 c);配位數是___;緊鄰的四個鎂原子的中心連線構成的正四面體幾何體的體積是2a cm3,鎂單質的密度為ρ gcm-3,已知阿伏德羅常數為NA,則鎂的摩爾質量的計算式是_______。
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】海洋植物,如海帶、海藻中含有豐富的碘元素,碘元素以碘離子的形式存在。實驗室里從海帶中提取碘的流程如下:
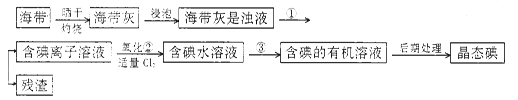
(1)指出提取碘的過程中有關的實驗操作名稱:①____________________;③______________。
若實驗②中采用酸性條件下加入雙氧水,則有關反應的離子方程式_________________________________。
(2)提取碘的過程中,可供選擇的有關試劑是___________。
A.甲苯,酒精B.四氯化碳,苯C.汽油,乙酸D.汽油,甘油
(3)含碘的有機溶液后期處理得到晶態碘需要進行的操作為___________;
最后,晶態碘在___________里聚集。
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】常溫下,向1 L 0.1 mol·L-1一元酸HR溶液中逐漸通入氨氣[已知常溫下NH3·H2O電離平衡常數K=1.76×10-5],使溶液溫度和體積保持不變,混合溶液的pH與離子濃度變化的關系如下圖所示。下列敘述正確的是

A. 0.1 mol·L-1 HR溶液的pH為5
B. HR為弱酸,常溫時隨著氨氣的通入,c(R-)/[c(OH-).c(HR)] 逐漸增大
C. 當通入0.1 mol NH3時,c(NH4+)>c(R-)>c(OH-)>c(H+)
D. 當c(R-)= c(HR)時,溶液必為中性
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】某化學興趣小組為探究Cl2、Br2、Fe3+的氧化性強弱,設計了如下實驗:
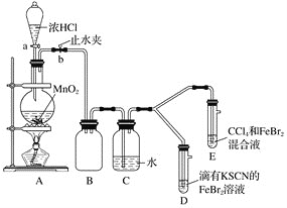
(1)①裝置A中發生反應的離子方程式是____________________。
②整套實驗裝置存在一處明顯的不足,請指出__________________。
(2)用改正后的裝置進行實驗,實驗過程如下:_______。
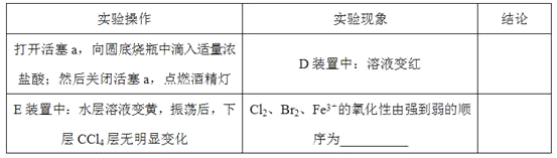
(3)因忙于觀察和記錄,沒有及時停止反應,D、E中均發生了新的變化。D裝置中:紅色慢慢褪去。E裝置中:CCl4層先由無色變為橙色,后顏色逐漸加深,直至變成紅色。
為探究上述實驗現象的本質,小組同學查得資料如下:
i.Fe3+3SCN-![]() Fe(SCN)3是一個可逆反應。
Fe(SCN)3是一個可逆反應。
ii.(SCN)2性質與鹵素單質類似、氧化性:Cl2>(SCN)2。
iii.Cl2和Br2反應生辰BrCl,BrCl呈紅色(略帶黃色),沸點約5℃,它與水能發生水解反應,且該反應為非氧化還原反應。
iv.AgClO、AgBrO均可溶于水。
①用平衡移動原理(結合上述資料)解釋Cl2過量時D中溶液紅色褪去的原因_______,現設計簡單實驗證明上述解釋:取少量褪色后的溶液,滴加___________溶液,若溶液顏色________,則上述解釋是合理的。
②探究E中顏色變化的原因,設計實驗如下:
用分液漏斗分離出E的下層溶液,蒸餾、收集紅色物質,取少量,加入AgNO3溶液,結果觀察到僅有白色沉淀產生。請結合上述資料用兩步方程式(離子或化學方程式不限定)解釋僅產生白色沉淀的原因:__________________。
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】鋰二次電池新正極材料的探索和研究對鋰電池的發展非常關鍵。
(1) 鋰硒電池具有優異的循環穩定性。
①正極材料Se可由SO2通入亞硒酸(H2SeO3)溶液反應制得,則該反應的化學方程式為__。
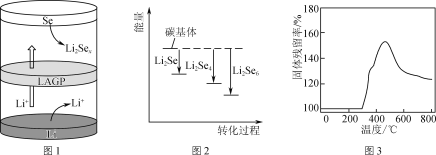
②一種鋰硒電池放電時的工作原理如圖1所示,寫出正極的電極反應式:________________。充電時Li+向________(填“Se”或“Li”)極遷移。
③ Li2Sex與正極碳基體結合時的能量變化如圖2所示,圖中3種Li2Sex與碳基體的結合能力由大到小的順序是________。
(2) Li2S電池的理論能量密度高,其正極材料為碳包裹的硫化鋰(Li2S)。
① Li2S可由硫酸鋰與殼聚糖高溫下制得,其中殼聚糖的作用是________。
②取一定量Li2S樣品在空氣中加熱,測得樣品固體殘留率隨溫度的變化如圖3所示。(固體殘留率=![]() ×100%)分析300 ℃后,固體殘留率變化的原因是________。
×100%)分析300 ℃后,固體殘留率變化的原因是________。
查看答案和解析>>
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com