
【題目】低溫脫硝技術可用于處理廢氣中的氮氧化物,發生的化學反應為:2NH3(g)+NO(g)+NO2(g)![]() 2N2(g)+3H2O(g) △H<0,在恒容的密閉容器中,下列有關說法正確的是
2N2(g)+3H2O(g) △H<0,在恒容的密閉容器中,下列有關說法正確的是
A. 平衡時,其他條件不變,升高溫度可使該反應的速率加快,平衡常數增大
B. 平衡時,其他條件不變,增加NH3的濃度,廢氣中氮氧化物的轉化率減小
C. 單位時間內消耗NO和N2的物質的量比為1∶2時 ,反應達到平衡
D. 其他條件不變,使用高效催化劑,廢氣中氮氧化物的轉化率增大
科目:高中化學 來源: 題型:
【題目】為比較Fe3+和Cu2+對H2O2分解的催化效果,某化學研究小組的同學分別設計了如圖甲、乙所示的實驗.下列敘述中不正確的是( )
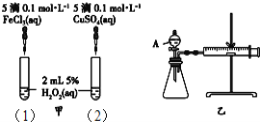
A. 實驗中H2O2分解的速率為(1)>(2)
B. 圖乙實驗可通過測定相同狀況下,產生的氣體體積與反應時間來比較反應速率
C. H2O2分解的熱化學方程式2H2O2(l)═2H2O(l)+O2(g)△H>0
D. 圖甲中(1)、(2)兩個實驗中H2O2分解的△H相同
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】下圖![]() 為直流電源,
為直流電源,![]() 為浸透飽和氯化鈉溶液和酚酞試液的濾紙,
為浸透飽和氯化鈉溶液和酚酞試液的濾紙,![]() 為電鍍槽.接通電路后發現
為電鍍槽.接通電路后發現![]() 上的c點顯紅色,為實現鐵上鍍鋅,接通
上的c點顯紅色,為實現鐵上鍍鋅,接通![]() 后,使c、d兩點短路.下列敘述正確的是
后,使c、d兩點短路.下列敘述正確的是
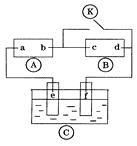
A. a為直流電源的負極
B. c極發生的反應為2H++2e-=H2↑
C. f電極為鋅板
D. e極發生還原反應
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】短周期主族元素R、W、X、Y、Z的原子序數依次增大,R的簡單氫化物可用作制冷劑,X是短周期中金屬性最強的元素。Y的簡單離子在同周期元素的簡單離子中半徑最小,由W、X和Z三種元素形成的一種鹽溶于水后,加入稀鹽酸,有黃色沉淀(Z的單質)析出,同時產生有刺激性氣味的氣體(Z的氧化物)。下列說法正確的是( )
A. 原子半徑:Z>Y>X>W
B. Z的簡單氫化物的熱穩定性比W的強
C. Y的氧化物既可溶于R的最高價氧化物對應的水化物水溶液,也可溶于R的氫化物水溶液
D. X與W、Z形成的化合物不少于三種
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】氰化物有劇毒,我國工業廢水中氰化物(CN-)的最高允許排放濃度為0.5 mg/L。對廢水中CN-的處理方法是:在堿性條件下,用Cl2將廢水中的CN-轉化成N2和CO2等,使廢水得到凈化。發生的反應為2CN-+8OH-+5Cl2===2CO2+N2+10Cl-+4H2O。下列有關說法不正確的是( )
A. 上述反應中氧化產物有N2和CO2
B. 經測定,NaCN的水溶液呈堿性,說明CN-能促進水的電離
C. 若上述反應生成0.4 mol CO2,則溶液中陰離子增加的物質的量為2 mol
D. 現取1 L含CN-1.02 mg/L的廢水,至少需用5.0×10-5 mol Cl2處理后才符合排放標準
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】工業上以軟錳礦(主要成分是MnO2,含有SiO2、Fe2O3等少量雜質)為主要原料制備高性能的磁性材料碳酸錳(MnCO3)。其工業流程如下圖所示:
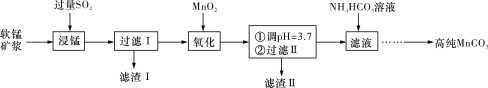
(1)“過濾Ⅰ”所得“濾渣Ⅰ”的主要成分為_________(填化學式)。
(2)“氧化”過程中除了發生MnO2與SO2的反應外,還發生另一氧化還原反應,寫出該反應的離子方程式______________________________________________________________。
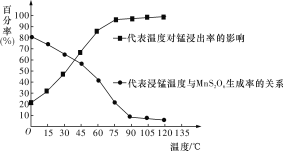
(3)“浸錳”反應中往往有副產物MnS2O6生成,溫度對“浸錳”反應的影響如圖所示,為減少MnS2O6的生成,“浸錳”的適宜溫度是____________________________________。
(4)向“過濾Ⅱ”所得的濾液中加入NH4HCO3溶液時溫度控制在30~35 ℃,溫度不宜太高的原因是_________________________________________________________________。
(5)加入NH4HCO3溶液后,生成MnCO3沉淀,同時還有CO2氣體生成,寫出反應的離子方程式:_____________________________________________________________________。
(6)生成的MnCO3沉淀需經充分洗滌,檢驗沉淀是否洗滌干凈的方法是___________________________________________________________________________。
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】已知反應:2A(g)+B(g)![]() 2C(g)
2C(g)
(1)在一個體積為2L的密閉容器中充入6 mol A和3mol B進行上述反應,保持溫度不變,2min后達到平衡,測得混合氣體中B的體積分數為25%,用A濃度變化表示的化學反應速率為___________,求該溫度下平衡常數K=______________;
(2)下圖表示在密閉容器中上述反應達到平衡時,由于條件改變而引起反應速率和化學平衡的變化情況,a~b過程中改變的條件可能是________;b~c過程中改變的條件可能是________;請將增大壓強時,反應速度變化情況畫在c~d處。____________
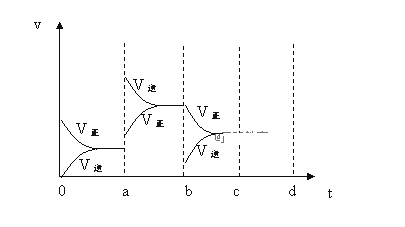
(3)以上反應達平衡后,若此時只將容器的體積擴大為原來的2倍,達新平衡后,容器內溫度將______(填“升高”、“降低”或“不變”(假設容器不與外界進行熱交換))。
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】已知:CO2(g)+3H2(g)![]() CH3OH(g)+H2O(g) ΔH=-49.0 kJ·mol-1。一定條件下,向體積為1 L的恒容密閉容器中充入1 mol CO2和3 mol H2,測得CO2和CH3OH(g)的濃度隨時間變化曲線如圖所示。下列敘述中正確的是 ( )
CH3OH(g)+H2O(g) ΔH=-49.0 kJ·mol-1。一定條件下,向體積為1 L的恒容密閉容器中充入1 mol CO2和3 mol H2,測得CO2和CH3OH(g)的濃度隨時間變化曲線如圖所示。下列敘述中正確的是 ( )

A. 3min時,用CO2的濃度表示的正反應速率等于用CH3OH的濃度表示的逆反應速率
B. 從反應開始到平衡,H2的平均反應速率v(H2)=0.225 mol·L-1·min-1
C. 13min時,向容器中充入2 mol氦氣,該反應的化學反應速率增加
D. 13min時,向容器中充入2 mol氦氣,CO2的轉化率增加
查看答案和解析>>
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com