
【題目】已知SO2可以用Fe(NO3)3溶液吸收,按如圖所示裝置展開相關探究:取一定量的銅片于三頸燒瓶中,通入一段時間N2后再加入足量的濃硫酸,加熱;裝置A中有白霧(硫酸酸霧)生成,裝置B中產生白色沉淀。回答下列問題:
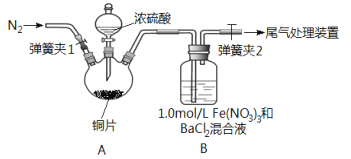
(i)裝置A中用于添加濃硫酸的儀器名稱為_________________。
(2)實驗開始前需進行的操作是_____________________。
(3)加入濃硫酸之前先通入N2一段時間,其目的是_____________________。
(4)排除裝置A中白霧影響,可在裝置A、B間增加洗氣瓶C,則C中盛放的試劑是_______;若用NaOH溶液處理尾氣,則發生反應的離子方程式為_________________。
(5)經過討論,該小組對裝置B中產生沉淀的原因,提出下列假設(不考慮各因素的疊加);假設1:裝置A中白霧進入裝置B中參與了反應;
假設2:______________;
假設3: Fe(NO3)3溶液顯酸性,在此酸性條件下NO3-能氧化SO2。
(6)請你設計實驗驗證上述假設3,寫出實驗步驟、預期現象和結論。
實驗步驟(簡述操作過程) | 預期現象和結論 |
①測1.0mol/LFe(NO3)3溶液的pH ②取與Fe(NO3)3溶液中c(NO3-)相同的適量Ba(NO3)2溶液滴入試管中 (3)________________ ④向試管中通入適量SO2氣體 | _____________ |
(7)若假設2正確,請寫出B中發生反應的離子方程式:_________________。
【答案】 分液漏斗 檢查裝置的氣密性 排除空氣的干擾 飽和NaHSO4溶液 SO2+2OH-==SO32-+H2O SO2被Fe3+氧化為SO42- 向試管中滴加少許稀硝酸,調節pH與①相同 若有白色沉淀,則假設3成立;反之,則假設3不成立 2Fe3++SO2+2H2O==2Fe2++SO42-+4H+ Ba2++SO42-==BaSO4↓
【解析】(1)根據裝置構造可知該儀器名稱是分液漏斗;(2)實驗開始前需進行的操作是檢查裝置的氣密性;(3)裝置中含有空氣,空氣中氧氣能氧化亞鐵離子干擾實驗,所以通入氮氣的目的是排除空氣的干擾;(4)排除裝置A中白霧影響,可在裝置A、B間增加洗氣瓶C,C中盛放的物質能吸收硫酸且不能吸收二氧化硫、不能引進新的雜質,則需要飽和NaHSO3溶液;二氧化硫屬于酸性氧化物,能和堿溶液發生反應生成鹽和水,離子方程式為SO2+2OH-==SO32-+H2O;(5)鐵離子具有氧化性、二氧化硫具有還原性,二者發生氧化還原反應生成硫酸根離子,因此假設3是SO2被Fe3+氧化為SO42-;(6)要驗證假設3,硝酸鐵是強酸弱堿鹽,其溶液呈酸性,要證明是酸性條件下硝酸根離子氧化二氧化硫,可以用硝酸的強堿鹽溶液、少量稀硝酸,然后向溶液中通入少量二氧化硫觀察實驗現象,第三步操作是向試管中滴加少許稀硝酸,調節pH與①相同;通過以上一系列操作,如果溶液中有白色沉淀生成就說明假設3成立,否則假設3不成立;(7)鐵離子把SO2氧化為硫酸,硫酸與氯化鋇反應產生白色沉淀,反應的離子方程式為2Fe3++SO2+2H2O==2Fe2++SO42-+4H+、Ba2++SO42-==BaSO4↓。


科目:高中化學 來源: 題型:
【題目】海冰是海水凍結而成的咸水冰。海水凍結時,部分來不及流走的鹽分以鹵汁的形式被包圍在冰晶之間,形成“鹽泡”![]() 假設鹽分以一個NaCl計
假設鹽分以一個NaCl計![]() ,其大致結構如下圖所示,若海冰的冰齡達到1年以上,融化后的水為淡水。下列敘述正確的是( )
,其大致結構如下圖所示,若海冰的冰齡達到1年以上,融化后的水為淡水。下列敘述正確的是( )

A.海冰內層“鹽泡”越多,密度越小
B.海冰冰齡越長,內層的“鹽泡”越多
C.海冰內層“鹽泡”內的鹽分主要以NaCl分子的形式存在
D.海冰內層NaCl的濃度約為![]() 設冰的密度為
設冰的密度為![]()
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】C是一種合成樹脂,高分子化合物,用于制備塑料和合成纖維,D是一種植物生長調節劑,用它可以催熟果實。根據以下化學反應框圖填空:

(1)寫出A的電子式:____________;D的結構簡式為____________。
(2)寫出碳化鈣與水反應制取A的化學方程式: _______________________。
(3)寫出由B生成C的化學方程式: __________________,其反應類型為_________。
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】一定條件下的恒溫恒容密閉容器中發生反應X(g)+3Y(g)![]() 2Z(g),若X、Y、Z的起始濃度分別為c1、c2、c3(均不為零),達到平衡時,X、Y、Z的濃度分別為0.1mol/L、0.3mol/L、0.08mol/L。則下列判斷正確的是
2Z(g),若X、Y、Z的起始濃度分別為c1、c2、c3(均不為零),達到平衡時,X、Y、Z的濃度分別為0.1mol/L、0.3mol/L、0.08mol/L。則下列判斷正確的是
A. c1:c2=1:2 B. 平衡時,Y和Z的生成速率之比為2:3
C. 若反應正向進行,X、Y的轉化率不相等 D. c1的取值范圍為0<c1<0.14mol/L
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】無水MgBr2常用于催化劑。某化學小組在實驗室選用下圖所示裝置 (夾持裝置略)采用鎂屑與液溴為原料制備無水MgBr2。

已知:①在濃硫酸存在下,加熱到140℃時乙醇脫水生成乙醚(C2H5OC2H5),加熱到170℃時乙醇脫水生成CH2 = CH2。
②乙醚的熔點為34.6℃,沸點為132℃。
③Mg和Br2劇烈反應,放出大量的熱;MgBr2具有強吸水性;MgBr2能與乙醚發生反應 MgBr2 +3C2H5OC2H5 ![]() MgBr2 3C2H5OC2H5。
MgBr2 3C2H5OC2H5。
實驗主要步驟如下:
I.選用上述部分裝置,正確連接,檢查裝置的氣密性。向裝置中加入藥品。
II.加熱裝置A,迅速升溫至140℃,并保持140℃加熱一段時間,停止加熱。
III.通入干燥的氮氣,讓液溴緩慢進入裝置B中,直至完全加入。
IV.裝置B中反應完畢后恢復至室溫,過濾反應物,將得到的濾液轉移至干燥的燒瓶中,在冰水中冷卻,析出晶體,再過濾得三乙醚合溴化鎂粗產品。
V.用苯洗滌粗產品,減壓過濾,得三乙醚合溴化鎂,將其加熱至160℃分解得無水 MgBr2。
回答下列問題:
(1)裝置A中使用儀器m的優點是________。
(2)步驟I中所選裝置的正確連接順序是a________ (填小寫字母)。裝置D的作用是________。
(3)若加熱裝置A一段時間后發現忘記加入碎瓷片,應該采取的正確操作是________。
(4)步驟V中用苯洗滌三乙醚合溴化鎂的目的是________。
(5)步驟V采用減壓過濾(使容器內壓強降低,以達到固液快速分離)。下列裝置可用作減壓過濾的是________(填序號)。

(6)實驗中若溫度控制不當,裝置B中會產生CH2Br—CH2Br。請設計實驗驗證 CH2Br—CH2Br的存在:從反應后的混合物中分離提純得到CH2Br—CH2Br,_______。
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】咖啡酸具有止血功效, 存在于多種中藥中, 其結構簡式如下圖, 則下列有關說法正確的是
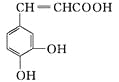
A. 該物質苯環上的一氯代物有2種
B. 1 mol該物質可以與1.5 mol碳酸鈉溶液反應生成1.5 mol的CO2
C. 既能發生取代反應, 也能發生加成反應
D. 所有碳原子不可能都在同一個平面上
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】碳及其化合物在化工生產中有著廣泛的應用。
I.為解決大氣中CO2的含量增大的問題,某科學家提出如下構想:把工廠排出的富含CO2的廢氣經凈化吹入碳酸鉀溶液吸收,然后再把CO2從溶液中提取出來,在合成塔中經化學反應使廢氣中的CO2轉變為燃料甲醇。部分技術流程如下:
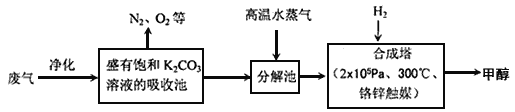
(1)吸收池中反應的化學方程式為K2CO3+CO2+H2O=2KHCO3,△H<0。該反應為可逆反應,從平衡移動原理分析,低溫有利于提高原料氣的平衡轉化率。而實際生產中采用300℃的溫度,其原因是 ____________________,_________________________
(2)已知:CH4(g)+2O2(g)=CO2(g)+2H2O(l) △H1=-890.3kJ/mol
2H2(g)+O2(g)=2H2O(l) △H2=-571.6kJ/mol
如將CO2與H2以1:4的體積比混合,在適當的條件下可制得CH4。寫出CO2(g)與H2(g)反應生CH4(g)與液態水的熱化學方程式_____________。
II.某興趣小組模擬工業合成甲醇的反應:CO(g)+2H2(g)![]() CH3OH(g),在容積固定為2L的密閉容器中充入1mol CO和2mol H2,加入合適的催化劑(催化劑體積忽略不計)后開始反應。測得容器內的壓強隨時間變化如下:
CH3OH(g),在容積固定為2L的密閉容器中充入1mol CO和2mol H2,加入合適的催化劑(催化劑體積忽略不計)后開始反應。測得容器內的壓強隨時間變化如下:
時間/min | 0 | 5 | 10 | 15 | 20 | 25 |
壓強/Mpa | 12.6 | 10.8 | 9.5 | 8.7 | 8.4 | 8.4 |
(1)從反應開始到20min時,以CO表示反應速率為___________________
(2)下列描述能說明反應達到平衡![]() 是_______
是_______
A.裝置內CO和H2的濃度比值不再改變
B.容器內氣體的平均摩爾質量保持不變
C.容器內氣體的壓強保持不變
D.容器內氣體密度保持不變
(3)該溫度下平衡常數K=_______,若達到平衡后加入少量CH3OH(g),此時平衡常數K值將_________ (填“增大”、“減小”或“不變”)
(4)該反應達到平衡后,再向容器中充入1mol CO和2mol H2,此時CO的轉化率將_____(填“增大”、“減小”或“不變”)
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】下列有機反應屬于取代反應的是
A.CH2=CH2+H2O![]() CH3CH2OH
CH3CH2OH
B.nCH2=CH2![]()
![]()
C.2CH3CH2OH+O2![]() 2CH3CHO+2H2O
2CH3CHO+2H2O
D.CH3COOH+CH3CH2OH![]() CH3COOCH2CH3+H2O
CH3COOCH2CH3+H2O
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】氨氣是一種重要的化工產品,在生產和科研中應用廣泛,氫氣是工業合成氨的原料之一,工業上制取氨氣有下列兩種途徑:
途徑一、用水和天然氣作原料一步反應制得
途徑二,用煤和水作原料經多步反應制得
請回答下列問題:
(1)途徑一反應的還原產物是______。
(2)途徑二中的一步反應為:![]()
①上述反應達到平衡后,為提高CO的轉化率,下列措施中正確的是______![]() 填寫序號
填寫序號![]() 。
。
A.增大壓強 ![]() 降低溫度
降低溫度 ![]() 增大
增大![]() 的濃度
的濃度 ![]() 使用催化劑
使用催化劑
②已知1000K時,上述反應的平衡常數![]() ,若要使CO的轉化率超過
,若要使CO的轉化率超過![]() ,則起始時
,則起始時![]() :
:![]() 不低于______。
不低于______。
③在容積為2L的容器中發生上述反應,測得![]() 與反應時間t的變化曲線Ⅰ如圖1所示,若在
與反應時間t的變化曲線Ⅰ如圖1所示,若在![]() 時刻將容器的體積擴大至4L,請在答題卡圖中繪出
時刻將容器的體積擴大至4L,請在答題卡圖中繪出![]() 與反應時間變化的曲線Ⅱ。____________
與反應時間變化的曲線Ⅱ。____________
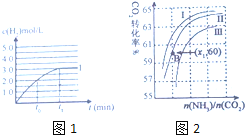
(3)目前常用氨氣處理硝酸生產的工業尾氣,在![]() 左右且有催化劑存在的情況下,氨氣能把
左右且有催化劑存在的情況下,氨氣能把![]() 還原成無色無毒氣體,直接排入空氣中,已知氫氣的燃燒熱為
還原成無色無毒氣體,直接排入空氣中,已知氫氣的燃燒熱為![]() ,
,![]() ,
,![]() 。試寫出氨氣與
。試寫出氨氣與![]() 反應生成無毒氣體和液態水的熱化學方程式______。
反應生成無毒氣體和液態水的熱化學方程式______。
(4)工業上用氨和二氧化碳反應合成尿素,其反應為:CO2+2NH3=CO(NH2)2+H2O;![]() 生成過程中,原料氣常混有水蒸氣,
生成過程中,原料氣常混有水蒸氣,![]() 的轉化率與氨碳比
的轉化率與氨碳比![]() 、水碳比
、水碳比![]() 的變化關系如圖2所示:
的變化關系如圖2所示:
①曲線Ⅰ、Ⅱ、Ⅲ對應的水碳比最小的是______。
②若B點氨的轉化率為![]() ,則
,則![]() ______。
______。
(5)某同學將![]() 和
和![]() 按物質的量之比2:1通入水中,充分反應所得溶液中
按物質的量之比2:1通入水中,充分反應所得溶液中![]() 、
、![]() 、
、![]() 三種離子濃度由大到小的順序是______
三種離子濃度由大到小的順序是______![]() 已知:氨水、碳酸的電離平衡常數如表
已知:氨水、碳酸的電離平衡常數如表![]()
弱電解質 | 化學式 | 電離常數 |
氨水 |
|
|
碳酸 |
|
|
|
查看答案和解析>>
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com