
【題目】鹵塊的主要成分是MgCl2,此外還含有Fe3+、Fe2+和Mn2+等離子。若以它為原料按下圖所示工藝流程進行生產,可制得輕質氧化鎂。
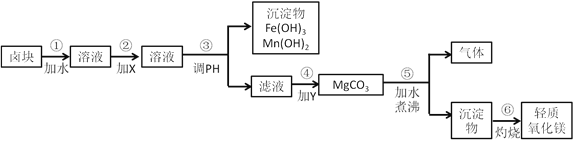
要求產品盡量不含雜質,而且生產成本較低,請根據表中提供的資料,回答下列問題。

(1)在步驟②中加入的試劑X,最佳的選擇是______,其作用是__________;
(2)在步驟④中加入的試劑Y是_______________________;
(3)在步驟⑤中發生反應的化學方程式是_____________________________。
【答案】 漂液 將亞鐵離子氧化成三價鐵離子 碳酸鈉 H2O+ MgCO3![]() Mg (OH) 2+CO2↑
Mg (OH) 2+CO2↑
【解析】(1)步驟②是為了將Fe2+氧化成Fe3+,并在控制合適的pH條件時生成Fe(OH)3 沉淀而除之.雖然漂液和H2O2都可采用,但對比表2提供的原料價格可以看出,漂液比H2O2的價格低得多,所以選漂液最合理,故答案為:漂液(NaClO),使Fe2+氧化成為Fe3+;(2))步驟④的目的是將Mg2+從溶液中沉淀出來.從MgCl2制得MgO,有兩種可行的方法,一種是向溶液中加入燒堿,另一種方法是向溶液中加入純堿,此處選用后一種方法更合理.一方面,加燒堿生成的中間產物Mg(OH)2 是膠狀沉淀,會造成過濾困難,更重要的是反應過程中不能進行輕化處理,只能得到重質氧化鎂;加純堿生成的中間產物MgCO3呈粗顆粒狀,易過濾,MgCO3在水中經一段時間的加熱會有部分反應生成CO2,由于CO2氣體的產生,使沉淀變得疏松,灼燒沉淀后得到的是輕質氧化鎂.另一方面,對比表2中燒堿和純堿的價格可以看出,純堿比燒堿價格低得多,采用純堿路線既合理又經濟,故答案為:純堿(Na2CO3);(3)步驟⑤中反應的化學方程式為:H2O+MgCO3![]() Mg(OH)2 +CO2↑
Mg(OH)2 +CO2↑


 星級口算天天練系列答案
星級口算天天練系列答案 芒果教輔達標測試卷系列答案
芒果教輔達標測試卷系列答案科目:高中化學 來源: 題型:
【題目】VL硫酸鈉中含Na+質量為m g,則
A. m/23V mol/L B.23/mV mol/L C.2m/23 V mol/L D. m/46Vmol/L
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】高錳酸鉀(KMnO4)是一種常用氧化劑,主要用于化工、防腐及制藥工業等。以軟錳礦(主要成分為MnO2)為原料生產高錳酸鉀的工藝路線如下:

回答下列問題:
(1)原料軟錳礦與氫氧化鉀按1∶1的比例在“烘炒鍋”中混配,混配前應將軟錳礦粉碎,其作用是_________________。
(2)“平爐”中發生的化學方程式為_________________,該條件下此反應的△S____0(填大于、小于或等于)。
(3)將K2MnO4轉化為KMnO4的生產有兩種工藝。
①“CO2歧化法”是傳統工藝,即在K2MnO4溶液中通入CO2氣體,使體系呈中性或弱堿性,K2MnO4發生歧化反應生成的含錳物質有KMnO4和MnO2,該反應的化學方程式為__________________。
②“電解法”為現代工藝,即電解K2MnO4水溶液,若用惰性電極,陽離子交換膜電解槽電解時產品純度高,陰極室中加入電解質溶液溶質的化學式為_______,電解時陽極發生的電極反應為____________,從陽極室的溶液得到產品的實驗操作是___________________。與傳統工藝比較,現代工藝的優點除產品純度高外還有_______________。
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】質譜測出,某烴A的相對分子質量為70,回答下列問題:
(1)下列物質與A以任意比例混合,若總物質的量一定,充分燃燒消耗氧氣的量相等的是(填序號)_______。
a.C2H4b.C3H8c.C6H6d.C4H6O
(2)若烴A為鏈烴,聯合紅外光譜及其它分析手段,顯示該分子含有3個-CH3。
①A的結構簡式為__________;
②鏈烴A與Br2的CCl4溶液反應生成B;B與NaOH的醇溶液共熱可得到D,D分子中無溴原子。(提示:碳原子連接兩個碳碳雙鍵的結構不穩定)。請寫出D的結構簡式______;D能發生聚合反應,且聚合產物主鏈含有碳碳雙鍵,寫出D生成E的反應方程式______________。
③B與足量NaOH水溶液完全反應,生成有機物F,該反應的化學方程式為______。
(3)若核磁共振氫譜顯示鏈烴A有四組不同的峰,峰面積比為6::2:1:1,則A的名稱為____。
(4)若A不能使溴水褪色,且其一氯代物只有一種,則A的結構簡式為_________。
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】亞硝酸鈉(NaNO2)有像食鹽一樣的咸味,被稱為工業鹽。已知:亞硝酸是弱酸,且NO+NO2 +2NaOH=2NaNO2+H2O。某同學據此認為NaNO2可與硫酸反應,且有NO和NO2生成,并欲用下圖所示儀器(夾持裝置已省略)及藥品,驗證自己的假設。已知沸點:NO2為21℃,NO為-151℃

(1)上述儀器的連接順序為:A→____→_____→_____→B。
(2)反應前,先打開彈簧夾,通入一段時間氮氣,其目的是____________。
(3)關閉彈簧夾,打開分液漏斗活塞,滴入70%硫酸后,A中產生了紅棕色氣體,
① 依據___________________現象,可確認產物中有NO
② 裝置E的作用是_________________。
(4)如果沒有裝置C,對實驗結論的影響是____________________。
(5)綜合以上信息推斷,NO2與NaOH溶液發生反應的化學方程式為_______________。
(6)己知:2NaNO2+4HI=2NaI+I2+2NO+2H2O,根據這一反應,可以用試劑和生活中的常見物質鑒別亞硝酸鈉和食鹽,進行實驗時,必須選用的物質有__________________。
A.自來水 B.碘化鉀溶液 C.淀粉 D.白糖 E. 食醋 F.白酒
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】二甲醚(CH3OCH3)--空氣燃料電池的工作原理如右圖所示。電池工作時,下列說法正確的是

A. a極區溶液的pH變大
B. b極有H2O生成
C. a極反應式:CH3OCH3+3O2--12e-=2CO2↑+6H+
D. 每消耗11.2LO2(標準狀況),有2molH+向左側移動
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】(12分)溴苯是一種常用的化工原料,通常以苯和溴為原料制取,查資料知:
苯 | 溴 | 溴苯 | |
密度/g·cm-3 | 0.88 | 3.10 | 1.50 |
沸點/℃ | 80 | 59 | 156 |
在水中的溶解度 | 微溶 | 微溶 | 微溶 |
實驗室制備溴苯的實驗步驟如下:
步驟1:在a中加入15 mL苯和少量鐵屑,再將b中4.0 mL液溴慢慢加入到a中。
步驟2:充分反應后,向a中加入10 mL水,然后過濾除去未反應的鐵屑。
步驟3:濾液依次用10 mL水、8 mL 10%的NaOH溶液、10 mL 水洗滌,分液得粗溴苯。
步驟4:向分出的粗溴苯中加入少量的無水氯化鈣,靜置、過濾即得粗產品。

(1)步驟1儀器a中發生的主要化學反應方程式為: 。
(2)儀器c的作用是冷凝回流,回流的主要物質有: 。
(3)步驟3中NaOH所發生的主要反應是: 。
(4)若將圖1虛線框部分改為圖2裝置,則 D、E可以檢驗出來的物質是 ,其中試管C中苯的作用是 ,能否據此判斷發生了取代反應? (填“是”或“否”)。
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】近年來AIST報告正在研究一種“高容量、低成本”鋰銅空氣燃料電池。該電池通過一種復雜的銅腐蝕“現象”產生電力,其中放電過程為2Li+Cu2O+H2O![]() 2Cu+2Li++2OH,下列說法不正確的是
2Cu+2Li++2OH,下列說法不正確的是

A. 放電時,負極的電極反應式為Cu2O+H2O+2e![]() 2Cu+2OH
2Cu+2OH
B. 放電時,Li+透過固體電解質向Cu極移動
C. 通空氣時,銅被腐蝕,表面產生Cu2O
D. 整個反應過程中,銅相當于催化劑
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】Ⅰ.CO2的轉化一直是全球研究的熱點,其中將CO2和H2合成甲醇及二甲醚 (CH3OCH3)具備相對成熟的技術。工業生產中,有以下相關反應
①CO2(g) + 3H2(g) ![]() CH3OH(l) + H2O(l) △H < 0
CH3OH(l) + H2O(l) △H < 0
②2 CH3OH(l) ![]() CH3OCH3(g) + H2O(l) △H < 0
CH3OCH3(g) + H2O(l) △H < 0
③CO(g) + H2O(l) ![]() CO2(g) + H2(g) △H < 0
CO2(g) + H2(g) △H < 0
(1)在一常溫恒容的密閉容器中,放入一定量的甲醇如②式建立平衡,以下說法正確并可以作為該反應達到平衡狀態的判斷依據為________。
A.容器內氣體相對分子質量保持不變
B.容器內氣體壓強不變
C.相同時間內消耗甲醇的量是消耗二甲醚的兩倍;
D.甲醇和二甲醚物質的量相等
(2)在三個體積相同的密閉容器A,B,C中加入相同物質的量的CO和H2O在不同溫度下發生反應③,經過相同時間后測得容器中的CO物質的量與溫度的關系如下圖:

① A、B兩點的速率大小v(A)___v(B)(填“大于”、“小于”、“等于”、“無法判斷”)
② 請解釋曲線中CO的物質的量先減小后增大的原因________________________。
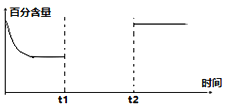
(3)一定量的CO2和H2在一密閉容器中發生反應①,下左圖是容器內CO2的百分含量隨著外界條件改變的變化曲線圖,請補充完整。(t1時刻升溫;t2時刻加催化劑)______

Ⅱ.SO2的尾氣處理通常用電化學處理法
(4)①如上右圖所示,Pt(Ⅱ)電極的反應式為__________________;
②當電路中轉移0.02mole-時(較濃H2SO4尚未排出),交換膜左側溶液中約增加_____mol離子。
查看答案和解析>>
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com