
某反應中反應物與生成物有:FeCl2、FeCl3、CuCl2、Cu。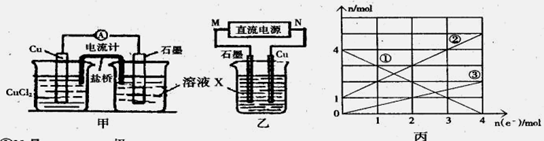
(1)將上述反應設計成的原電池如圖甲所示,請回答下列問題:
①圖中X溶液是 ;
②Cu電極上發生的電極反應式為 ;
③原電池工作時,鹽橋中的 離子(填“K+”或“Cl—”)不斷進入X溶液中。
(2)將上述反應設計成的電解池如圖乙所示,乙燒杯中金屬陽離子的物質的量與電子轉移的物質的量的變化關系如圖丙,請回答下列問題:
①M是 極;
②圖丙中的②線是_______________離子的變化。
③當電子轉移為2mol時,向乙燒杯中加入 L 5mol·L-1NaOH溶液才能使所有的金屬陽離子沉淀完全。
(3)鐵的重要化合物高鐵酸鈉(Na2FeO4)是一種新型飲用水消毒劑,具有很多優點。
①高鐵酸鈉生產方法之一是電解法,其原理為Fe+2NaOH+2H2O
 Na2FeO4+3H2↑,則電解時陽極的電極反應式是 。
Na2FeO4+3H2↑,則電解時陽極的電極反應式是 。
②高鐵酸鈉生產方法之二是在強堿性介質中用NaClO氧化Fe(OH)3生成高鐵酸鈉、氯化鈉和水,該反應的離子方程式為 。
③Na2FeO4能消毒、凈水的原因 。
(1)FeCl3和FeCl2 Cu-2e-=Cu2+ K+
(2)負 Fe2+ 2.8
(3) Fe+8OH--6e-=FeO42-+4H2O 2Fe(OH)3+3ClO-+4OH-=2FeO42-+3Cl-+5H2O
高價鐵具有氧化性,能消毒殺菌,生成Fe3+形成膠體,具有吸附懸浮物的凈水的作用。
解析試題分析:(1)根據反應物和生成物可以確定該反應為2FeCl3+Cu=2FeCl2+CuCl2,所以X為FeCl3和FeCl2溶液。Cu做負極,發生的電極反應為Cu-2e-=Cu2+,石墨為正極,陽離子向正極移動,所以K+不斷進入X溶液中。
(2)根據丙圖可知溶液中有三種金屬陽離子,而根據X的成分可知X中只有兩種金屬陽離子,說明在電解過程中還有Cu2+生成,因此Cu做陽極,石墨做陰極,所以M為負極,N為正極,根據轉移電子的物質的量和金屬陽離子的物質的量的變化,可知①為Fe3+,②為Fe2+,③為Cu2+。當電子轉移為2mol時,溶液中有Fe3+ 2mol,Fe2+ 3mol,Cu2+為1mol,所以需要加入NaOH溶液14mol,所以NaOH溶液等體積為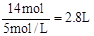 。
。
(3)電解時陽極發生氧化反應,電極反應方程式為Fe+8OH--6e-=FeO42-+4H2O。NaClO氧化Fe(OH)3的反應方程式為2Fe(OH)3+3ClO-+4OH-=2FeO42-+3Cl-+5H2O。Na2FeO4能消毒、凈水的原因高價鐵具有氧化性,能消毒殺菌,生成Fe3+形成膠體,具有吸附懸浮物的凈水的作用。
考點:原電池電解原理
點評:本題綜合性強,難度大,主要考查學生分析問題的能力,是高考的熱點習題。


科目:高中化學 來源: 題型:

查看答案和解析>>
科目:高中化學 來源:2010-2011學年貴州省高三五校第五次聯考(理綜)化學部分 題型:選擇題
某反應中反應物與生成物有: AsH3、H2SO4、KBrO3、K2SO4、H3AsO4、H2O和一種未知物質X。已知0.1mol KBrO3在反應中得到0.5mol電子生成X,則下列說法錯誤的是
A.氧化產物與還原產物的計量系數之比為5:2 B.氧化性:KBrO3>H3AsO4
C.AsH3 中As元素被氧化,發生氧化反應 D.X的化學式為Br2
查看答案和解析>>
科目:高中化學 來源: 題型:單選題
查看答案和解析>>
科目:高中化學 來源: 題型:
某反應中反應物與生成物有: AsH3、H2SO4、KBrO3、K2SO4、H3AsO4、H2O和一種未知物質X。已知0.1mol KBrO3在反應中得到0.5mol電子生成X,則下列說法錯誤的是
A.氧化產物與還原產物的計量系數之比為5:2 B.氧化性:KBrO3>H3AsO4
C.AsH3 中As元素被氧化,發生氧化反應 D.X的化學式為Br2
查看答案和解析>>
科目:高中化學 來源:2011屆貴州省高三五校第五次聯考(理綜)化學部分 題型:單選題
某反應中反應物與生成物有: AsH3、H2SO4、KBrO3、K2SO4、H3AsO4、H2O和一種未知物質X。已知0.1mol KBrO3在反應中得到0.5mol電子生成X,則下列說法錯誤的是
| A.氧化產物與還原產物的計量系數之比為5:2 | B.氧化性:KBrO3>H3AsO4 |
| C.AsH3中As元素被氧化,發生氧化反應 | D.X的化學式為Br2 |
查看答案和解析>>
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com