
分析 方案一:(1)該方案原理為在加熱的條件下Na2CO3能夠穩定存在,而NaHCO3較易發生如下的分解反應2NaHCO3$\frac{\underline{\;\;△\;\;}}{\;}$Na2CO3+CO2↑+H2O,從而根據殘留的固體的量推算出樣品中碳酸鈉的質量分數.
(2)該方案根據加熱后殘渣的質量來求解,要加熱至恒重,以保證NaHCO3全部分解.
方案二:根據實驗原理,用酚酞作指示劑時,發生反應為:Na2CO3+HCl=NaHCO3+NaCl,用0.1mol•L-1 HCl溶液滴定至終點,消耗0.1mol•L-1 HCl溶液V1 mL,繼續用甲基橙作指示劑滴定至終點,發生反應::NaHCO3+HCl=H2O+CO2↑+NaCl,由此分析計算;
方案三:該方案原理為在樣品中加入CaCl2溶液,其中Na2CO3可與CaCl2發生反應Na2CO3+CaCl2=CaCO3↓+2NaCl,而NaHCO3與CaCl2則不反應.從而根據產生的沉淀量,得出純堿的質量分數,方案關鍵是測定CaCO3沉淀的質量,自然要保證沉淀完全,要正確過濾好.
(3)沉淀會附著氯化鈉、氯化鈣.
(4)在一定量樣品中加入足量Ca(OH)2溶液,此時分別發生如下反應Na2CO3+Ca(OH)2=CaCO3↓+2NaOH,NaHCO3+Ca(OH)2=CaCO3↓+NaOH+H2O,均產生CaCO3沉淀,根據樣品的總量和生成CaCO3沉淀的量,就可得出純堿的質量分數.
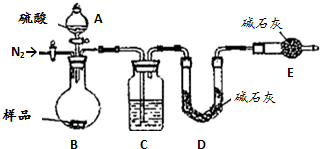
方案四:該方案原理為一定量混合樣品與足量的稀硫酸分別發生如下反應Na2CO3+H2SO4=Na2SO4+CO2↑+H2O,
2 NaHCO3+H2SO4=Na2SO4+2CO2↑+2H2O↑,根據所產生的CO2的質量,可以分別求得樣品中Na2CO3和NaHCO3的質量從而得出純堿的質量分數.該方案關鍵是要獲得產生的CO2的質量,在實驗前要檢查裝置的氣密性,要將裝置中的CO2全部被堿石灰所吸收,要稱量堿石灰在吸收CO2前后的質量.
(5)C裝置干燥二氧化碳.
(6)實驗前容器內含有空氣,空氣中含有二氧化碳,會影響生成的二氧化碳的量,反應后裝置中容器內含有二氧化碳,不能被C中堿石灰完全吸收,導致測定結果有較大誤差.
解答 解:方案一:(1)坩堝中發生反應的化學方程式為:2NaHCO3$\frac{\underline{\;\;△\;\;}}{\;}$Na2CO3+CO2↑+H2O,故答案為:2NaHCO3$\frac{\underline{\;\;△\;\;}}{\;}$Na2CO3+CO2↑+H2O;保證NaHCO3全部分解.
(2)該方案根據加熱后殘渣的質量來求解,要加熱至恒重,以保證NaHCO3全部分解,故答案為:加熱至恒重,以保證NaHCO3全部分解;
方案二:根據實驗原理,用酚酞作指示劑時,發生反應為:Na2CO3+HCl=NaHCO3+NaCl,用0.1mol•L-1 HCl溶液滴定至終點,消耗0.1mol•L-1 HCl溶液V1 mL,應根據V1來計算碳酸鈉的質量;繼續用甲基橙作指示劑滴定至終點,發生反應::NaHCO3+HCl=H2O+CO2↑+NaCl,消耗0.1mol•L-1HCl溶液V2mL.根據(V2-V1)計算NaHCO3的質量,則Na2CO3的質量分數為:$\frac{0.1mol/L×{V}_{1}×106g/mol}{0.1mol/L×{V}_{1}×106g/mol+0.1mol/L×({V}_{2}-{V}_{1})×84g/mol}$=$\frac{106{V}_{1}}{106{V}_{1}+84({V}_{2}-{V}_{1})}$×100%,故答案為:$\frac{106{V}_{1}}{106{V}_{1}+84({V}_{2}-{V}_{1})}$×100%;
方案三:
(3)碳酸鈣沉淀會附著氯化鈉、氯化鈣,過濾后需用蒸餾水洗滌沉淀;故答案為:洗滌沉淀;
(4)在一定量樣品中加入足量Ca(OH)2溶液,此時分別發生如下反應Na2CO3+Ca(OH)2=CaCO3↓+2NaOH,
NaHCO3+Ca(OH)2=CaCO3↓+NaOH+H2O,均產生CaCO3沉淀,根據樣品的總量和生成CaCO3沉淀的量,可以計算碳酸鈉質量,就可得出純堿的質量分數.故用氫氧化鈣溶液代替氯化鈣溶液作沉淀劑,在其他操作正確的情況下,測得樣品中的碳酸鈉質量分數不變;故答案為:不變;
方案四:
(5)C裝置干燥二氧化碳,所以C中盛放的物質是濃硫酸,故答案為:濃硫酸;
(6)該方案關鍵是要獲得產生的CO2的質量,實驗前容器內含有空氣,空氣中含有二氧化碳,會影響生成的二氧化碳的量,反應后裝置中容器內含有二氧化碳,不能被C中堿石灰完全吸收,導致測定結果有較大誤差,所以反應前后都要通入N2,反應后通入N2的目的是:排盡裝置內的空氣,將生成的二氧化碳從容器內排出,被D裝置中堿石灰吸收,
故答案為:排盡裝置內的空氣,將生成的二氧化碳從容器內排出,被D裝置中堿石灰吸收.
點評 以實驗探究“工業純堿(假設僅含碳酸氫鈉雜質)中碳酸鈉的質量分數”為載體,考查學生對于實驗原理與裝置理解評價、實驗基本操作、化學計算等,難度中等,題目涉及到的小蘇打和純堿的化學知識是多方面的,構成了一道多角度的探究題.


 名校課堂系列答案
名校課堂系列答案科目:高中化學 來源: 題型:選擇題
| A. | ③ | B. | ①④ | C. | ②③④ | D. | ②④ |
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| A | B | C | D | |
| 強電解質 | HCl | 酒精 | CH3COOH | NaCl |
| 弱電解質 | NH3•H2O | HClO | BaSO4 | NaOH |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
科目:高中化學 來源: 題型:解答題
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| A. | 用Fe2+將飲用水中少量ClO2-氧化成為Cl-:4Fe2++ClO2-+4H+═4Fe3++Cl-+2H2O | |
| B. | 向燒堿溶液中加入鋁:Al+2OH-═AlO2-+H2↑ | |
| C. | 用過量氨水吸收煙道氣中的SO2:SO2+2NH3•H2O═SO32-+2NH4++H2O | |
| D. | 將飽和FeCl3溶液滴入沸水中制取Fe(OH)3膠體:Fe3++3H2O?Fe(OH)3↓+3H+ |
查看答案和解析>>
科目:高中化學 來源: 題型:解答題
查看答案和解析>>
科目:高中化學 來源: 題型:填空題
 ,若該烷烴可由3種單烯烴與H2加成得到,則該烯烴可能的結構簡式是CH2=C(CH3)CH2CH3、(CH3)2C=CHCH3、(CH3)2CHCH=CH2.
,若該烷烴可由3種單烯烴與H2加成得到,則該烯烴可能的結構簡式是CH2=C(CH3)CH2CH3、(CH3)2C=CHCH3、(CH3)2CHCH=CH2.查看答案和解析>>
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com