
 .
.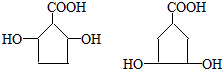 .
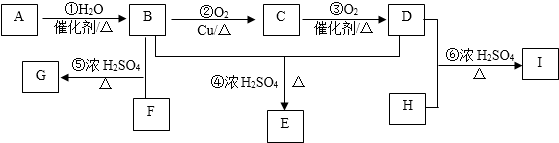
. 分析 某氣態烴A與H2的相對密度為14,Mr(A)=14×2=28,其產量可以用來衡量一個國家的石油化工發展水平,則A為CH2=CH2,乙烯與水發生加成反應生成B為CH3CH2OH,乙醇發生催化氧化生成C為CH3CHO,C進一步發生氧化反應生成D為CH3COOH,乙酸與乙醇發生酯化反應生成E為CH3COOCH2CH3.芳香族化合物F為C、H、O化合物,1mol F與足量NaHCO3溶液反應能生成2mol CO2,則F含有2個羧基,其相對分子質量為166,2個羧基、1個C6H4的總式量為45×2+(12×6+4)=166,則F含有1個苯環、2個羧基,且環上的一氯代物有一種,則F為 ,F與足量的B發生酯化反應生成G為
,F與足量的B發生酯化反應生成G為 ,H為二元醇,其蒸氣密度折算成標準狀況為2.77g/L,其相對分子質量為22.4×2.77=62,去掉2個羥基剩余基團式量為62-17×2=28,故為-C2H4-,則H為HOCH2CH2OH,H與足量D反應生成I為
,H為二元醇,其蒸氣密度折算成標準狀況為2.77g/L,其相對分子質量為22.4×2.77=62,去掉2個羥基剩余基團式量為62-17×2=28,故為-C2H4-,則H為HOCH2CH2OH,H與足量D反應生成I為 ,據此解答.
,據此解答.
解答 解:某氣態烴A與H2的相對密度為14,Mr(A)=14×2=28,其產量可以用來衡量一個國家的石油化工發展水平,則A為CH2=CH2,乙烯與水發生加成反應生成B為CH3CH2OH,乙醇發生催化氧化生成C為CH3CHO,C進一步發生氧化反應生成D為CH3COOH,乙酸與乙醇發生酯化反應生成E為CH3COOCH2CH3.芳香族化合物F為C、H、O化合物,1mol F與足量NaHCO3溶液反應能生成2mol CO2,則F含有2個羧基,其相對分子質量為166,2個羧基、1個C6H4的總式量為45×2+(12×6+4)=166,則F含有1個苯環、2個羧基,且環上的一氯代物有一種,則F為 ,F與足量的B發生酯化反應生成G為
,F與足量的B發生酯化反應生成G為 ,H為二元醇,其蒸氣密度折算成標準狀況為2.77g/L,其相對分子質量為22.4×2.77=62,去掉2個羥基剩余基團式量為62-17×2=28,故為-C2H4-,則H為HOCH2CH2OH,H與足量D反應生成I為
,H為二元醇,其蒸氣密度折算成標準狀況為2.77g/L,其相對分子質量為22.4×2.77=62,去掉2個羥基剩余基團式量為62-17×2=28,故為-C2H4-,則H為HOCH2CH2OH,H與足量D反應生成I為 ,
,
(1)A為CH2=CH2,含有官能團為:碳碳雙鍵,E的結構簡式為CH3COOCH2CH3,
故答案為:碳碳雙鍵;CH3COOCH2CH3;
(2)G為 ,其分子式為C12H14O4,反應⑤是羧酸與醇發生的酯化反應,也屬于取代反應,
,其分子式為C12H14O4,反應⑤是羧酸與醇發生的酯化反應,也屬于取代反應,
故答案為:C12H14O4;酯化反應或取代反應;
(3)反應②的化學方程式為:2CH3CH2OH+O2 $→_{△}^{Cu}$2CH3CHO+2H2O;
反應⑥的化學方程式為:2CH3COOH+HOCH2CH2OH $→_{△}^{濃硫酸}$CH3COOCH2CH2OOCCH3+2H2O,
故答案為:2CH3CH2OH+O2 $→_{△}^{Cu}$2CH3CHO+2H2O;2CH3COOH+HOCH2CH2OH $→_{△}^{濃硫酸}$CH3COOCH2CH2OOCCH3+2H2O;
(4) 與HOCH2CH2OH發生縮聚反應生成高分子化合物,該化學反應方程式為:
與HOCH2CH2OH發生縮聚反應生成高分子化合物,該化學反應方程式為: ,
,
故答案為: ;
;
(5)I( )有多種同分異構體,其中一類同分異構體有如下特征:
)有多種同分異構體,其中一類同分異構體有如下特征:
①分子中含有五元環結構;
②1mol該有機物與足量NaHCO3溶液反應,能生成1mol CO2,含有1個羧基,
③1mol該有機物與足量Na反應,能生成1.5mol H2,結合②可知,還含有2個羥基,
④環上的一氯代物只有三種,
則滿足以上條件的有機物的所有可能的結構簡式為: ,
,
故答案為: .
.
點評 本題考查有機物的推斷,注意根據F發生的反應判斷含有的官能團,再利用殘余法確定有機物F的結構簡式,側重合成學生分析推理能力,難度中等.


科目:高中化學 來源: 題型:選擇題
| A. | 氧化劑與還原劑的物質的量之比為1:4 | |
| B. | O2F2既是氧化劑又是還原劑 | |
| C. | 若生成4.48 L HF,則轉移0.8 mol電子 | |
| D. | 氧氣是還原產物 |
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| A. | 洗凈的容量瓶中殘留少量的蒸餾水 | B. | 溶解NaOH的燒杯未洗凈 | ||
| C. | 稱量NaOH時使用稱量紙 | D. | 定容時俯視刻度線 |
查看答案和解析>>
科目:高中化學 來源: 題型:解答題
 某溫度時在2L容器中X、Y、Z三種氣態物質的物質的量(n)隨時間(t)變化的曲線如圖所示,由圖中數據分析:
某溫度時在2L容器中X、Y、Z三種氣態物質的物質的量(n)隨時間(t)變化的曲線如圖所示,由圖中數據分析:查看答案和解析>>
科目:高中化學 來源: 題型:實驗題
查看答案和解析>>
科目:高中化學 來源: 題型:實驗題
| 物質 | Al | Al2O3 | Fe | Fe2O3 |
| 熔點/℃ | 660 | 2054 | 1535 | 1462 |
| 沸點/℃ | 2467 | 2980 | 2750 | -- |
 (4)圖中OC段沒有沉淀生成,此階段發生反應的離子方程式為H++OH-═H2O.
(4)圖中OC段沒有沉淀生成,此階段發生反應的離子方程式為H++OH-═H2O.查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| A. | 通入足量CO2后的溶液中:Na+、SiO32-、CH3COO-、CO32- | |
| B. | 中性溶液中:Fe3+、MnO4-、SO42-、K+ | |
| C. | 酸性溶液中:Na+、ClO-、SO42-、I- | |
| D. | $\frac{c({H}^{+})}{c(O{H}^{-})}$=1012的溶液中:NH4+、Al3+、NO3-、Cl- |
查看答案和解析>>
科目:高中化學 來源: 題型:解答題
| A組 | B組 | C組 | D組 |
| 金剛石:3550 | Li:181 | HF:-83 | NaCl:801 |
| 硅晶體:1410 | Na:98 | HCl:-115 | KCl:776 |
| 硼晶體:2300 | K:64 | HBr:-89 | RbCl:718 |
| 二氧化硅:1723 | Rb:39 | HI:-51 | CaCl:645 |
查看答案和解析>>
科目:高中化學 來源: 題型:填空題
查看答案和解析>>
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com