
下列操作中,后者最終能被漂白的是
A.將干燥的氯氣與紅色鮮花充分接觸 B.將H2 02加入到KMnO4溶液中
C.將足量SO2通人紫色石蕊試液中 D.將漂白液加入到Fe2 (SO4)3溶液中
 閱讀快車系列答案
閱讀快車系列答案科目:高中化學 來源:2016屆江蘇省宿遷市三校高三9月學情調研化學試卷(解析版) 題型:填空題
(10分)常溫下,將某一元酸HA(甲、乙、丙、丁代表不同的一元酸)和NaOH溶液等體積混合,兩種溶液的物質的量濃度和混合溶液的pH如表所示:
實驗 編號 | HA的物質的量 濃度(mol·L-1) | NaOH的物質的量 濃度(mol·L-1) | 混合后溶 液的pH |
甲 | 0.1 | 0.1 | pH=a |
乙 | 0.12 | 0.1 | pH=7 |
丙 | 0.2 | 0.1 | pH>7 |
丁 | 0.1 | 0.1 | pH=10 |
(1)從甲組情況分析,從a值大小如何判斷HA是強酸還是弱酸?_________________。
(2)乙組混合溶液中c(A-)和c(Na+)的大小關系是_______。
A.前者大 B.后者大 C.二者相等 D.無法判斷
(3)從丙組實驗結果分析,該混合溶液中離子濃度由大到小的順序是 。
(4)分析丁組實驗數據,寫出該混合溶液中下列算式的精確結果(列式):
c(Na+)-c(A-)=_______ mol·L-1。
(5)某二元酸(化學式用H2B表示)在水中的電離方程式是:H2B===H++HB-
HB- H++B2-。
H++B2-。
在0.1 mol·L-1的Na2B溶液中,下列粒子濃度關系式正確的是 。
A.c(B2-)+c(HB-)=0.1 mol·L-1
B.c(B2-)+c(HB-)+c(H2B)=0.1 mol·L-1
C.c(OH-)=c (H+)+c(HB-)
D.c(Na+)+c(OH-)=c(H+)+c(HB-)
查看答案和解析>>
科目:高中化學 來源:2016屆湖北省高三8月月考(開學摸底)化學試卷(解析版) 題型:選擇題
下列有關溶液組成的描述合理的是
A.無色溶液中可能大量存在Al3+、NH4+、Cl-、S2-
B.弱堿性溶液中可能大量存在Na+、K+、Cl-、HCO3-
C.酸性溶液中可能大量存在Na+、ClO-、SO42-、I-
D.中性溶液中可能大量存在Fe3+、K+、Cl-、SO42-
查看答案和解析>>
科目:高中化學 來源:2016屆河南省濮陽市心高三上第一次市統摸底化學試卷(解析版) 題型:選擇題
室溫下向10mL0.1 mol·L-1NaOH溶液中加入0.1 mol·L-1的一元酸HA溶液pH的變化曲線如圖所示。下列說法正確的是
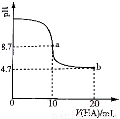
A.a點所示溶液中c(Na+)>c(A—)>c(H+)>c(HA)
B.a、b兩點所示溶液中水的電離程度相同
C.b點所示溶液中c(A—)> c(HA)
D.pH=7時,c(Na+)= c(A—)+ c(HA)
查看答案和解析>>
科目:高中化學 來源:2016屆河南省八市高三9月教學質量監測考試化學試卷(解析版) 題型:填空題
(14分)肼(N2H4)與N2O4,是火箭發射中最常用的燃料與助燃劑。
(1)已知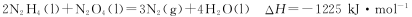
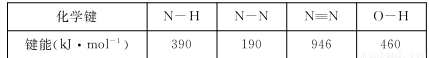
則使1 mol N2O4 (l)完全分解成相應的原子時需要吸收的能量是 。
(2)800℃時,某密閉容器中存在如下反應: ,若開始向容器中加入1 mol/L的NO2,反應過程中NO的產率隨時間的變化如下圖曲線I所示。
,若開始向容器中加入1 mol/L的NO2,反應過程中NO的產率隨時間的變化如下圖曲線I所示。
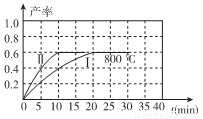
①反應Ⅱ相對于反應I而言,改變的條件可能是 。
②請在圖中繪制出在其它條件與反應I相同時,反應在820℃時進行,NO的產率隨時間的變化曲線。
③800℃時,若開始時向容器中同時加入1 mol/L NO、0.2 mol/L O2、0.5 mol/L NO2,則v(正)____v(逆)。
(3)己知 ,t時,將一定量的NO2、N2O4,充人一個容器為2L的恒容密閉容器中,濃度隨時間變化關系如下表所示:
,t時,將一定量的NO2、N2O4,充人一個容器為2L的恒容密閉容器中,濃度隨時間變化關系如下表所示:
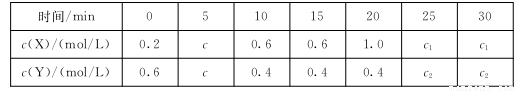
①c( X)代表 (填化學式)的濃度,該反應的平衡常數K= 。
②前10 min內用NO2表示的反應速率為 ,20 min時改變的條件是 ;重新達到平衡時,NO2的百分含量 (填選項前字母)。
a.增大 b.減小 c.不變 d.無法判斷
查看答案和解析>>
科目:高中化學 來源:2016屆河北省高三9月月考化學試卷(解析版) 題型:選擇題
現有三種常見治療胃病藥品的標簽:

藥品中所含的物質均能中和胃里過量的鹽酸,關于三種藥片中和胃酸的能力比較,正確的是
A.①=②=③ B.①>②>③ C.③>②>① D.②>③>①
查看答案和解析>>
科目:高中化學 來源:2014-2015學年上海市高三第一學期第一次月考化學試卷(解析版) 題型:填空題
(本題共8分)二氧化碳和氫氣在一定條件下可以制得烯烴,該技術已成為節能減碳的有效途徑之一。已知二氧化碳和氫氣按1:3比例可合成烯烴B, B的產量是衡量一個國家石油化工水平的標志。下圖是合成橡膠和TNT的路線。

已知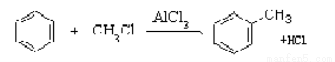
1.工業上由煤焦油提取苯的操作名稱為_______。E的結構簡式為__________________。
2.寫出反應類型:反應②________________;反應③__________________。
3.寫出反應D+E的化學方程式______________________ _。
4.D在一定條件下與足量H2反應后的產物,其一氯代物有_________種。
查看答案和解析>>
科目:高中化學 來源:2015-2016學年河北正定中學高二上學期第一次聯考化學試卷(解析版) 題型:選擇題
室溫下,向20.00 mL 1.000 mol·L-1氨水中滴入1.000 mol·L-1鹽酸,溶液pH和溫度隨加入鹽酸體積變化曲線如圖所示。下列有關說法正確的是

A.氨水的電離程度a>b>c
B.a、d兩點的溶液,水的離子積Kw(a)>Kw(d)
C.c點時消耗鹽酸體積V(HCl)<20 .00ml
D.d點時溶液溫度達到最高,之后溫度略有下降,原因是NH3·H2O電離吸熱
查看答案和解析>>
科目:高中化學 來源:2016屆安徽省江南十校新高三摸底聯考化學試卷(解析版) 題型:簡答題
【選修2:化學與技術】(13分)材料是人類賴以生存和發展的重要物質基礎,回答下列問題:
(1)下列生產工藝能獲取新型無機非金屬材料的是(填序號)
①采用甲烷為原料,在微波和其他條件下生產金剛石
②在玻璃生產過程中加人K、Pb生產其有特殊用途的光學玻璃
③在水泥生產過程中加入高爐礦渣生產特殊用途的水泥
④采用傳統方法用焦炭還原SiO2制備單晶硅
(2)某煉鐵高爐中一次投入磁鐵礦冶煉生鐵,若不考慮其他的的反應,也不考慮生鐵中的雜質,則煉得的生鐵為3.36 t.,該過程中轉移的電子數為 mol,生鐵中含碳、硫等元素較多,煉鋼是以生鐵為原料,除去過多的碳、硫等雜質元素,其中除去硫的化學方程式為
(3)工業煉金屬鋁的工藝流程如下:

該工藝中冰晶石和氟化鈣的作用是 ,物質W的化學式為
(4)金屬腐蝕帶來的損失無法估量。鋼鐵腐蝕多為吸氧腐蝕,其正極反應式為 _
查看答案和解析>>
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com