

| A. | 乙苯的同分異構體共有三種 | |
| B. | 可用Br2/CCl4鑒別乙苯和苯乙烯 | |
| C. | 乙苯和苯乙烯分子中均含有碳碳雙健 | |
| D. | 乙苯和苯乙烯分子內共平面的碳原子數均為7 |
分析 A.乙苯的同分異構體可為二甲苯,有鄰、間、對等,也可能不含苯環;
B.乙苯和溴不反應,苯乙烯和溴發生加成反應;
C.苯環中不存在碳碳雙鍵;
D.苯環和碳碳雙鍵都為平面形,與苯環直接相連的原子在同一個平面上.
解答 解:A.乙苯的同分異構體可為二甲苯,有鄰、間、對,連同乙苯共4種,如不含苯環,則同分異構體種類更多,故A錯誤;
B.苯乙烯可與溴發生加成反應,溶液褪色,而乙苯不反應,可鑒別,故B正確;
C.苯環和乙基中不含碳碳雙鍵,故C錯誤;
D.苯環和碳碳雙鍵都為平面形,與苯環直接相連的原子在同一個平面上,則乙苯有7個碳原子共平面,苯乙烯有8個碳原子共平面,故D錯誤;
故選B.
點評 本題考查有機物結構和性質,為高頻考點,側重于學生的分析能力的考查,明確官能團與性質關系即可解答,側重考查基本概念、烯烴、基本反應類型等知識點,易錯選項是D.


 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小學生10分鐘應用題系列答案
小學生10分鐘應用題系列答案科目:高中化學 來源: 題型:解答題
| 鍵 | H-H | N-H | N-N | N=N | N≡N |
| 鍵能/kJ•mol-1 | 436 | 391 | 159 | 418 | 945 |
| 分子式 | 結構簡式 | 熔點 | 沸點 | 水溶性 | |
| 乙醇 | C2H6O | C2H5OH | -114.3℃ | 78.4°C | 互溶 |
| 二甲醚 | C2H6O | CH3OCH3 | -138.5℃ | -24.9℃ | 微溶 |
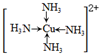 .
.查看答案和解析>>
科目:高中化學 來源: 題型:實驗題
 在容積為1.00L的容器中,通入一定量的N2O4,發生反應N2O4(g)?2NO2(g),隨溫度升高,混合氣體的顏色變深.回答下列問題:
在容積為1.00L的容器中,通入一定量的N2O4,發生反應N2O4(g)?2NO2(g),隨溫度升高,混合氣體的顏色變深.回答下列問題:查看答案和解析>>
科目:高中化學 來源: 題型:推斷題
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| A. | 2SO2(g)+O2(g)?2SO3(g);△H=-2a KJ/mol | B. | 2SO2(g)+O2(g)2?SO3(g);△H=-a KJ/mol | ||
| C. | SO2(g)+$\frac{1}{2}$O2(g)?SO3(g);△H=a KJ/mol | D. | SO2(g)+$\frac{1}{2}$O2(g)?SO3(g);△H=-2a KJ/mol |
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| A. | 有氣體生成 | |
| B. | Na+濃度基本不變 | |
| C. | HCO3-濃度減小而CO32-濃度增大 | |
| D. | SO32-發生反應的離子方程式為:SO32-+Na2O2+H2O=2Na++SO42-+2OH- |
查看答案和解析>>
科目:高中化學 來源: 題型:解答題
 1,3-丁二烯(CH2=CHCH=CH2)和2-丁炔(CH3C CH3)是重要的有機原料.
1,3-丁二烯(CH2=CHCH=CH2)和2-丁炔(CH3C CH3)是重要的有機原料.查看答案和解析>>
科目:高中化學 來源: 題型:實驗題
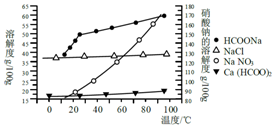 甲酸鈣廣泛用于食品、化工、石油等工業生產上,300~400℃左右分解.
甲酸鈣廣泛用于食品、化工、石油等工業生產上,300~400℃左右分解.| 金屬 離子 | 開始沉淀 的pH | 沉淀完全 的pH |
| Fe3+ | 1.1 | 3.2 |
| Al3+ | 3.0 | 5.0 |
| Fe2+ | 5.8 | 8.8 |
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| A. | 煙花燃放,五彩繽紛的焰火體現了某些金屬元素的物理性質 | |
| B. | “霧霾天氣”、“溫室效應”、“光化學煙霧”的形成都與氮氧化物無關 | |
| C. | 淀粉和纖維素都能水解,水解最終產物都為葡萄糖 | |
| D. | 利用CO2合成聚碳酸酯類可降解塑料,實現“碳”的循環利用 |
查看答案和解析>>
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com