
下列說法不正確的是( )
A.電解熔融氯化鈉制取金屬鈉的反應中,鈉離子被還原
B.鋅-銅-稀硫酸組成的原電池中,銅片表面產生大量氣泡
C.濃硫酸溶于水使溶液溫度升高,說明濃硫酸的溶解是放熱反應
D.鋁熱法還原鐵的反應中,放出的熱量能使鐵熔化
 閱讀快車系列答案
閱讀快車系列答案科目:高中化學 來源:2015-2016學年陜西省高一下學期期末化學試卷(解析版) 題型:實驗題
葡萄可用于釀酒。
(1)檢驗葡萄汁含葡萄糖的方法是:向其中加堿調至堿性,再加入新制備的Cu(OH)2,加熱,其現象是_______________________________________。
(2)葡萄在釀酒過程中,葡萄糖轉化為酒精的過程如下,補充完成下列化學方程式。
C6H12O6(葡萄糖)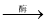 2________+2C2H5OH
2________+2C2H5OH
(3)葡萄酒密封儲存過程中生成了有香味的酯,酯也可以通過
化學實驗來制備。實驗室用下圖所示裝置制備乙酸乙酯:
①試管a中生成乙酸乙酯的化學方程式是 ________________________________。
②試管b中盛放的試劑是飽和_________________溶液。
③實驗開始時,試管b中的導管不伸入液面下的原因是___________________。
④若分離出試管b中生成的乙酸乙酯,需要用到的儀器是____(填序號)。
a.漏斗 b.分液漏斗 c.長頸漏斗
(4)某有機物的結構簡式為HOOC—CH=CHOH。驗證該有機物中含有-COOH官能團常采用的方法是 ,產生的現象為 。
查看答案和解析>>
科目:高中化學 來源:2015-2016學年山東省泰安市高二下學期期末化學試卷(解析版) 題型:選擇題
某些牙膏中含有茶多酚,茶多酚是茶葉中多酚類物質的總稱,是目前尚不能人工合成的純天然、 多功能、高效能的抗氧化劑和自由基凈化劑。其中沒食子兒茶素(GC)的結構簡式如圖所示,下列關于GC的敘述中正確的是( )

A.分子中所有的原子共面
B.1 mol GC與6 mol NaOH恰好完全反應
C.能發生氧化反應、取代反應、消去反應,難發生加成反應
D.遇FeCl3溶液不發生顯色反應
查看答案和解析>>
科目:高中化學 來源:2015-2016學年廣東省高一下期末化學試卷(解析版) 題型:實驗題
某實驗小組利用如圖給定的儀器組成一套實驗裝置(各儀器只允許用一次),在室溫、 1.01×105 Pa的條件下測定鎂的相對原子質量。
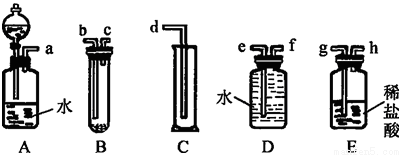
請回答下列問題:
(1)假設氣流方向為左→右,則各儀器的接口連接的先后順序為 (用小寫字母填寫)。
(2)連接好儀器后,要進行的操作有以下幾步:
①待儀器B中的物質恢復至室溫時,測量量筒 C中水的體積(假定將測定的體積換算成標準狀況下為 V mL);
②擦掉鎂條表面的氧化膜,將其置于天平上稱量(假定其質量為m g,并將其放入試管B中);
③檢查各裝置的氣密性;
④旋開儀器A上分液漏斗的活塞,當鎂條完全溶解時再關閉活塞。
上述幾步操作的先后順序是 。
(3)根據實驗數據可計算出鎂的相對原子質量,其數學表達式為 。
(4)若未將試管B冷卻至室溫就測量量筒C中水的體積,這將會使所測鎂的相對原子質量數據 (填“偏大”“偏小”或“無影響”)。
(5)若未擦凈鎂條表面的氧化膜就進行實驗,這將會使所測鎂的相對原子質量數據 (填“偏大”“偏小”或“無影響”)。
(6)實驗中需要用480 mL 1 mol/L的鹽酸,配制過程中用于定容的玻璃儀器的規格和名稱是
。
查看答案和解析>>
科目:高中化學 來源:2015-2016學年廣東省高一下期末化學試卷(解析版) 題型:選擇題
空間實驗室“天宮一號”的供電系統中有再生氫氧燃料電池,堿性氫氧燃料電池的電極反應為負極:2H2+4OH--4e-=4H2O;正極:O2+2H2O+4e-=4OH-。該電池工作時,下列敘述正確的是( )
A.氫氣發生還原反應
B.轉移4 mol e- 時電池內增加4 mol H2O
C.負極附近溶液的pH值降低
D.正極附近c(H+) 增大
查看答案和解析>>
科目:高中化學 來源:2015-2016學年廣東省高一下期末化學試卷(解析版) 題型:選擇題
如圖是制取、凈化并測量生成氣體體積的裝置示意圖。利用如圖裝置進行下表所列實驗,能達到實驗目的的是( )
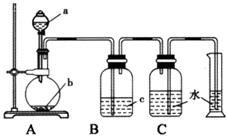
選項 | a(液體) | b(固體) | c(液體) |
A. | 稀鹽酸 | 鋅粒 | 濃硫酸 |
B. | 濃氨水 | 生石灰 | 濃硫酸 |
C. | 濃硫酸 | Cu片 | NaOH溶液 |
D. | 稀硝酸 | Cu片 | H2O |
查看答案和解析>>
科目:高中化學 來源:2015-2016學年甘肅省通渭縣高二下期末理綜化學試卷(解析版) 題型:實驗題
[化學——選修2化學與技術]高鐵酸鉀(K2FeO4)是一種集氧化、吸附、絮凝于一體的新型多功能水處理劑=其生產工藝如下:
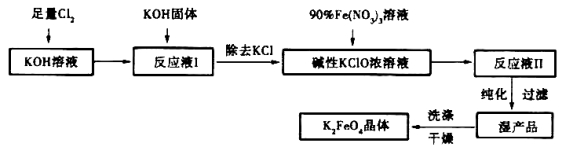
已知:①2KOH + Cl2 = KCl + KClO + H2O(條件:溫度較低)
②6KOH + 3C12 = 5KCl + KClO3 +3H2O(條件:溫度較高)
③2Fe(NO3)3 +2KC1O + 10KOH = 2K2FeO4 + 6KNO3 +2KCl + 5H2O
回答下列問題:
(1)該生產工藝應在_______(填“溫度較高”或“溫度較低”)的情況下進行;
(2)寫出工業上制取Cl2的化學方程式_________________________;
(3)K2FeO4可作為新型多功能水處理劑的原因____________________;
(4)配制KOH溶液時,是在每100mL水中溶解61.6 g KOH固體(該溶液的密度為1.47 g/mL),它的物質的量濃度為__________
(5)在“反應液I”中加KOH固體的目的是
①_______________,
②______________________________;
(6)從“反應液II”中分離出K2FeO4后,副產品是__________ (寫化學式)。
查看答案和解析>>
科目:高中化學 來源:2015-2016學年北京市高二下期末化學試卷(解析版) 題型:選擇題
在一定溫度下和壓強下,1體積X2(氣)跟3體積Y2(氣)化合生成2體積氣體化合物,則該化合物的分子式是( )
A.XY3 B.XY C.X3Y D.X2Y3
查看答案和解析>>
科目:高中化學 來源:2015-2016學年黑龍江哈爾濱六中高二下期末化學試卷(解析版) 題型:填空題
(1)用零價鐵(Fe)去除水體中的硝酸鹽(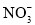 )已成為環境修復研究的熱點之一。Fe還原水體中
)已成為環境修復研究的熱點之一。Fe還原水體中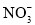 的反應原理如右圖所示。
的反應原理如右圖所示。
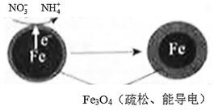
①作負極的物質是________。②正極的電極反應式是________ _。
(2)甲醇既是重要的化工原料,又可作為燃料,利用合成氣(主要成分為CO、CO2和H2)在催化劑作用下合成甲醇,發生的主要反應如下:
①CO(g)+2H2(g)  CH3OH(g) △H1
CH3OH(g) △H1
②CO2(g)+3H2(g)  CH3OH(g)+H2O(g) △H2
CH3OH(g)+H2O(g) △H2
③CO2(g)+H2(g)  CO(g) +H2O(g) △H3
CO(g) +H2O(g) △H3
已知反應①中相關的化學鍵鍵能數據如下:
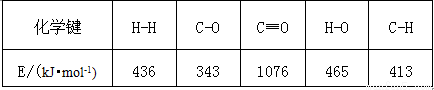
由此計算△H1= kJ·mol-1.已知△H2= –58kJ·mol-1,則△H3= kJ·mol-1.
查看答案和解析>>
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com