
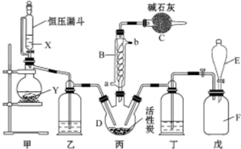
 磺酰氯(SO2Cl2)是一種重要的有機合成試劑,實驗室可利用SO2與Cl2反應制取少量的SO2Cl2,裝置如圖(有些夾持裝置省略)所示.已知SO2Cl2的熔點為-54.1℃,沸點為69.1℃,遇水能發生劇烈的水解反應,并產生白霧.
磺酰氯(SO2Cl2)是一種重要的有機合成試劑,實驗室可利用SO2與Cl2反應制取少量的SO2Cl2,裝置如圖(有些夾持裝置省略)所示.已知SO2Cl2的熔點為-54.1℃,沸點為69.1℃,遇水能發生劇烈的水解反應,并產生白霧.分析 由(4)戊是貯氯氣裝置,可知甲裝置制備二氧化硫,二氧化硫與氯氣在丙中反應生成SO2Cl2,丙中活性炭可能起催化劑作用,SO2Cl2遇水發生劇烈的水解反應,乙為干燥二氧化硫,E中盛放溶液加入戊中排出裝置內氯氣,可以是飽和食鹽水,降低氯氣溶解度,丁干燥氯氣,SO2Cl2沸點低、易揮發,B為冷凝管,使揮發的產物SO2Cl2冷凝回流,堿石灰吸收為反應的二氧化硫、氯氣,防止污染空氣,并吸收空氣中的水蒸氣,防止進入C中導致磺酰氯水解.
1)根據裝置圖可知,儀器B的名稱為球形冷凝管,作用是冷凝回流而反應又沒有加熱,據此判斷SO2與氯氣間的反應的熱效應,由于會有一部分Cl2、SO2通過冷凝管逸出,故C中應使用堿性試劑,又因SO2Cl2遇水易水解,故堿石灰是用于吸收氯氣、SO2并防止空氣中的水蒸氣進入B中;
(2)可以利用甲裝置中空氣熱脹冷縮產生壓強差的原理來檢驗氣密性;
(3)甲是制備SO2的裝置,銅與濃硫酸反應需要加熱,硝酸能氧化SO2,據此答題;
(4)因氯水不溶于飽和食鹽水,故E中的試劑是飽和食鹽水.氯氣在水存在的條件下可將SO2氧化成硫酸,自身被還原為HCl.
(5)分離沸點不同的液體可以用蒸餾的方法,標準狀況下,896mlCl2為0.04mol,故理論上可得到0.04molSO2Cl2,由此可求出產率.
解答 解:(1)根據裝置圖可知,儀器B的名稱為球形冷凝管,因蛇形冷凝管的作用是冷凝回流而反應又沒有加熱,故SO2與氯氣間的反應為放熱反應,由于會有一部分Cl2、SO2通過冷凝管逸出,故C中應使用堿性試劑,又因SO2Cl2遇水易水解,故堿石灰是用于吸收氯氣、SO2并防止空氣中的水蒸氣進入B中,
故答案為:球形冷凝管;<;吸收逸出都有毒的Cl2、SO2,防止空氣中的水蒸氣進入C,防止污染環境及磺酰氯水解;
(2)檢驗甲裝置氣密性的方法是:塞好恒壓漏斗上方的塞子,將蒸餾燒瓶的導氣管進入水中,酒精燈微熱,導管口有氣泡產生,停止加熱,導管口有一段液柱產生,則裝置的氣密性良好,
故答案為:塞好恒壓漏斗上方的塞子,將蒸餾燒瓶的導氣管進入水中,酒精燈微熱,導管口有氣泡產生,停止加熱,導管口有一段液柱產生,則裝置的氣密性良好;
(3)甲是制備SO2的裝置,銅與濃硫酸反應需要加熱,硝酸能氧化SO2,所以用c.60% H2SO4+K2SO3來制備SO2,故選c;
(4)因氯水不溶于飽和食鹽水,故E中的試劑是飽和食鹽水,氯氣在水存在的條件下可將SO2氧化成硫酸,自身被還原為HCl,反應的方程式為SO2+Cl2+2H2O=H2SO4+2HCl,
故答案為:飽和食鹽水;SO2+Cl2+2H2O=H2SO4+2HCl;
(5)分離沸點不同的液體可以用蒸餾的方法,所以丙中混合物分離開的實驗操作是蒸餾,標準狀況下,896mlCl2為0.04mol,故理論上可得到0.04molSO2Cl2,即為0.04×135g=5.4g,所以SO2Cl2的產為$\frac{3.3g}{5.4g}$×100%=61.1%,故答案為:蒸餾;61.1%.
點評 本題考查實驗制備方案,為高考常見題型,側重于學生的分析、實驗和計算能力的考查,涉及對反應原理、裝置及操作的分析評價、對儀器的識別、物質的分離提純等,注意對物質性質信息的應用,難度中等.


 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小學生10分鐘應用題系列答案
小學生10分鐘應用題系列答案科目:高中化學 來源: 題型:實驗題
 圖為實驗室制溴苯的實驗裝置圖,請根據圖回答下列問題
圖為實驗室制溴苯的實驗裝置圖,請根據圖回答下列問題 .
.查看答案和解析>>
科目:高中化學 來源: 題型:解答題
查看答案和解析>>
科目:高中化學 來源: 題型:實驗題
查看答案和解析>>
科目:高中化學 來源: 題型:解答題
查看答案和解析>>
科目:高中化學 來源: 題型:實驗題
| 加熱前的質量 | 加熱后的質量 | ||
| W1(容器) | W2(容器+晶體) | W3(容器+無水硫酸銅) | |
| 第一次 | 15.688g | 17.668g | 16.962g |
| 第二次 | 15.688g | 17.744g | 17.033g |
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| A. | ①②④⑤ | B. | ②③⑥⑦ | C. | ②⑤⑥⑦ | D. | ①③⑥⑦ |
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| A. | ⑤④①③② | B. | ④①②⑤③ | C. | ②⑤④①③ | D. | ①④②⑤③ |
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| A. | 升高溫度,正反應的反應速率變快,逆反應速率變慢,平衡向正反應方向移動 | |
| B. | 減小反應物濃度,逆反應的速率變慢,正反應速率變快,平衡向正反應方向移動 | |
| C. | 增大壓強,正反應的反應速率加快,逆反應速率也加快,平衡向正反應方向移動 | |
| D. | 加入正催化劑,對正反應的反應速率影響更大 |
查看答案和解析>>
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com