
分析 當向反應后的溶液中逐滴加入0.2mol•L-1的NaOH溶液,當Mg2+恰好完全沉淀,消耗NaOH溶液體積為50mL,此時溶質為氯化鈉,根據組成守恒n(HCl)=n(NaOH)=0.2mol•L-1×0.05L=0.01mol,由此分析解答.
解答 解:向反應后的溶液中逐滴加入0.2mol•L-1的NaOH溶液,當Mg2+恰好完全沉淀,消耗NaOH溶液體積為50mL,此時溶質為氯化鈉,根據組成守恒n(HCl)=n(NaOH)=0.2mol•L-1×0.05L=0.01mol,
(1)鹽酸的物質的量濃度為$\frac{0.01mol}{0.1L}$=0.1mol•L-1,故答案為:0.1;
(2)根據得失電子守恒:n(Mg)=n(H2)=$\frac{100.8mL×1{0}^{-3}L/mL}{22.4L/mol}$=0.0045mol,而投入100mL某濃度的鹽酸中,鎂條恰好完全溶解,此時得到單一溶質氯化鎂,所以氯化鎂的物質的量為:$\frac{0.01mol}{2}$=0.005mol,所以氧化鎂的物質的量為:0.005mol-0.0045mol=0.0005mol,所以該鎂條中未被氧化的鎂和被氧化的鎂的物質的量之比為:0.0045mol:0.0005mol=9:1,故答案為:9:1.
點評 本題考查混合物計算,難度中等,注意利用守恒法解答,側重對學生的分析能力與解題方法技巧的考查.


 走進文言文系列答案
走進文言文系列答案科目:高中化學 來源: 題型:選擇題
| A. | 反應①是最節能的,同時原子利用率最高 | |
| B. | 反應①是最節能的,反應③的原子利用率最高 | |
| C. | 在反應②中,CO2作為氧化劑 | |
| D. | 反應④得到的產物可以作為生產塑料的原料 |
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| A. | CH2=CH-CH=CH2 1,3-二丁烯 | B. | 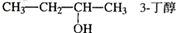 | ||
| C. | 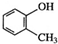 甲基苯酚 甲基苯酚 | D. | 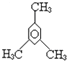 1,3,5-三甲基苯 1,3,5-三甲基苯 |
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| A. | Fe3+、K+、Ag+、NO3-、 | B. | Na+、K+、CO32-、C1- | ||
| C. | NH4+、Al3+、Cl-、NO3- | D. | Mg2+、Na+、CO32-、SO42- |
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| A. | M元素位于周期表中的第三周期第VIA族 | |
| B. | Z元素是硅,其在自然界中存在游離態 | |
| C. | X與M的單質在高溫下反應得到的二元化合物分子中,存在極性共價鍵 | |
| D. | 四種元素中的Y單質可用于航空航天合金材料的制備 |
查看答案和解析>>
科目:高中化學 來源: 題型:推斷題
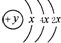 ,B、C可形成離子化合物B3C2,B離子與C離子具有相同的電子層結構,D的氣態氫化物H2D的還原性較強.
,B、C可形成離子化合物B3C2,B離子與C離子具有相同的電子層結構,D的氣態氫化物H2D的還原性較強. .
.查看答案和解析>>
科目:高中化學 來源: 題型:填空題
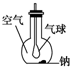 如圖所示裝置,在平底燒瓶的底部有一塊鈉,平底燒瓶內是干燥的空氣.過一段時間后可觀察到鈉表面變暗,氣球膨脹,發生反應的化學方程式為4Na+O2═2Na2O.
如圖所示裝置,在平底燒瓶的底部有一塊鈉,平底燒瓶內是干燥的空氣.過一段時間后可觀察到鈉表面變暗,氣球膨脹,發生反應的化學方程式為4Na+O2═2Na2O.查看答案和解析>>
科目:高中化學 來源: 題型:填空題
查看答案和解析>>
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com