
【題目】一定條件下,體積不變容器中,N2(g) + 3H2(g) ![]() 2NH3(g) ΔH=-92.4 kJ·mol-1,在反應過程中,反應速率的變化如圖所示,下列說法不正確的是( )
2NH3(g) ΔH=-92.4 kJ·mol-1,在反應過程中,反應速率的變化如圖所示,下列說法不正確的是( )

A. t1時刻增大c(N2)或c(H2)B. t2時刻加入催化劑
C. t3時刻降低溫度D. t4時刻往容器中充入He,以增大體系壓強
【答案】D
【解析】
由圖象可知,t1時正反應速率突然增大,逆反應速率不變;t2時正、逆反應速率同等程度增大,t3時正、逆反應速率突然減小,t4時正、逆反應速率突然增大,結合影響化學反應速率和化學平衡的因素分析解答。
A.t1時正反應速率突然增大,逆反應速率不變,正反應速率大于逆反應速率,則平衡正向移動,應為增大反應物濃度,故A正確;
B.t2時正、逆反應速率同等程度增大,平衡不移動,則為使用了催化劑,故B正確;
C.t3時正、逆反應速率突然減小,正反應速率大于逆反應速率,則平衡正向移動,該反應為放熱反應,則為降低溫度,故C正確;
D.t4時正、逆反應速率突然增大,正反應速率大于逆反應速率,則平衡正向移動,則應為增大壓強,但往容器中充入He,以增大體系壓強,反應物和生成物濃度不變,平衡不移動,故D錯誤;
故選D。


科目:高中化學 來源: 題型:
【題目】在25℃時,向20.00mL0.10mol/L一元弱堿MOH溶液中滴0.10mol/LHCl溶液,混合溶液的pH、pOH變化曲線如圖所示。已知pOH=-lgc(OH-)。下列說法錯誤的是( )
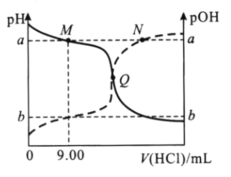
A.a+b=14
B.Q點消耗鹽酸的體積小于20.00mL
C.M點和N點溶液中,![]() 相等
相等
D.當V(HCl)=10.00mL時,c(M+)-c(MOH)=c(OH-)-c(H+)
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】二甲醚主要用于替代汽車燃油、制氫及用于燃料電池原料。 回答下列問題
⑴二甲醚在加熱條件下能發生分解:(CH3)2O(g)→CH4(g)+H2(g)+CO(g),在某溫度壓強下測定其動力學數據如下:
t/s | 0 | 200 | 400 | 600 | 800 |
c[(CH3)2O]/mol·L-1 | 0.01000 | 0.00916 | 0.00839 | 0.00768 | 0.00702 |
0~800s 的二甲醚平均反應速率為__________________ 。
⑵一種“直接二甲醚燃料電池”結構如下圖所示,電解質為強酸溶液。電池工作時,能量轉化方式為______,負極的電極反應式為 ____。

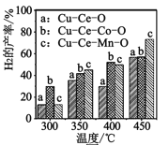
⑶二甲醚與水蒸氣重整制 H2,相同投料比及流速時,單位時間內 H2 產率與催化劑及溫度下關系如下圖 所示,適宜的催化劑是______(選填 a、b、c)及適宜的溫度是____ 。
⑷工業中用 CO 和 H2 為原料可制取二甲醚,在 250℃、5MPa 及催化劑作用下,在反應器中合成。
a:3CO(g)+3H2(g) CH3OCH3(g)+CO2(g) K1
b:2CO(g)+4H2(g) CH3OCH3(g)+H2O(g) K2
c:CO(g)+2H2(g) CH3OH(g)
已知:投料比 n(H2)/n(CO2)與原料氣轉化率的關系如下圖 所示。
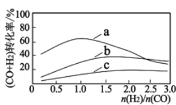
①最佳 n(H2)/n(CO)比為_________________ (填圖中數字)。
②同一溫度下,CO(g)+H2O(g) CO2(g)+H2(g)平衡常數為 K3,則 K3=__________用含 K1、K2 代數式表示)。
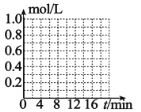
⑸已知反應 CO2(g)+3H2(g) CH3OH(g)+H2O(g)。一定條件下,向體積為 1L 的密閉容器中充入 1molCO2和 3molH2,測得 3min 時υ(H2)=0.5mol/L·min,10min 時達到平衡,平衡時,CO2 轉化率為 75%,在下圖中 畫出 CO2 和 CH3OH(g)的濃度隨時間變化曲線________。
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】下列有關膠體的說法中,正確的是( )
A.根據是否具有丁達爾現象,將分散系分為溶液、濁液和膠體
B.向沸水中逐滴加入少量飽和FeCl3溶液,可制得Fe(OH)3膠體
C.將Fe(OH)3膠體和泥水分別過濾,發現均不能通過濾紙孔隙
D.用光束分別照射稀豆漿、FeCl3溶液都可以觀察到丁達爾現象
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】于固定體積的密閉容器中進行的氣體反應A(g)+B(g) ![]() C(s)+2D(g),可以說明在恒溫下已達到平衡狀態的是
C(s)+2D(g),可以說明在恒溫下已達到平衡狀態的是
①反應容器中壓強不隨時間變化而變化 ②A氣體和B氣體的生成速率相等 ③混合氣體的平均摩爾質量不隨時間變化而變化 ④反應混合氣體的密度不隨時間變化而變化
A. ③④B. ②③C. ①③D. ①④
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】下列說法正確的是( )
A. 對于N2(g) + 3H2(g) ![]() 2NH3(g)達到平衡,在溫度不變、容積不變的密閉容器中充入N2,化學平衡常數變大
2NH3(g)達到平衡,在溫度不變、容積不變的密閉容器中充入N2,化學平衡常數變大
B. 對某一可逆反應,升高溫度則化學平衡常數一定變大
C. 平衡常數發生變化,化學平衡必定發生移動達到新的平衡
D. 改變條件,使反應物的平衡轉化率都增大,該可逆反應的平衡常數一定增大
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】研究表明CO與N2O在Fe+作用下發生反應的能量變化及反應歷程如圖所示,兩步反應分別為:①N2O+Fe+=N2+FeO (慢):②FeO++CO=CO2+Fe+ (快)。下列說法正確的是
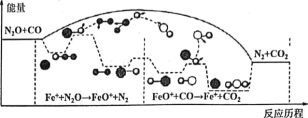
A. 反應①是氧化還原反應,反應②是非氧化還原反應
B. 兩步反應均為放熱反應,總反應的化學反應速率由反應②決定
C. Fe+使反應的活化能減小,FeO+是中間產物
D. 若轉移lmol電子,則消耗II.2LN2O
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】鉻、鉬![]() 、鎢
、鎢![]() 都是ⅥB族元素,且原子序數依次增大,它們的單質和化合物在生活、生產中有廣泛應用。
都是ⅥB族元素,且原子序數依次增大,它們的單質和化合物在生活、生產中有廣泛應用。
![]() 鉻元素的最高化合價為________;基態鉬原子的核外電子排布類似于基態鉻原子,其原子核外有________個未成對電子。
鉻元素的最高化合價為________;基態鉬原子的核外電子排布類似于基態鉻原子,其原子核外有________個未成對電子。
![]() 鉬可作有機合成的催化劑。例如,苯甲醛被還原成環己基甲醇。
鉬可作有機合成的催化劑。例如,苯甲醛被還原成環己基甲醇。
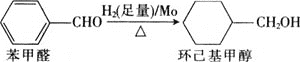
![]() 環己基甲醇分子中采取
環己基甲醇分子中采取![]() 雜化的原子是________
雜化的原子是________![]() 寫元素符號
寫元素符號![]() 。
。
![]() 環己基甲醇的沸點高于苯甲醛,其原因是________。
環己基甲醇的沸點高于苯甲醛,其原因是________。
![]() 鉻離子
鉻離子![]() 能形成多種配合物,例如
能形成多種配合物,例如![]() 。
。
![]() 已知配合物的中心粒子的配位數指配位原子總數。上述配合物中,
已知配合物的中心粒子的配位數指配位原子總數。上述配合物中,![]() 的配位數為________。
的配位數為________。
![]() 上述配合物中的非金屬元素按電負性由小到大的順序排列為________。
上述配合物中的非金屬元素按電負性由小到大的順序排列為________。
![]() 鉻的一種氧化物的晶胞結構如圖所示。
鉻的一種氧化物的晶胞結構如圖所示。
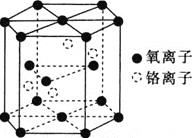
![]() 該氧化物的化學式為________。
該氧化物的化學式為________。
![]() 已知晶胞底面的邊長為acm,晶胞的高為bcm,
已知晶胞底面的邊長為acm,晶胞的高為bcm,![]() 代表阿伏加德羅常數的值,該鉻的氧化物的摩爾質量為
代表阿伏加德羅常數的值,該鉻的氧化物的摩爾質量為![]() 。該晶體的密度為________
。該晶體的密度為________![]() 用含a、b、
用含a、b、![]() 和M的代數式表示
和M的代數式表示![]() 。
。
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】聯氨(N2H4)和次磷酸鈉(NaH2PO2)都具有強還原性.都有著廣泛的用途。
(1)已知:①N2H4(l)+O2(g)=N2(g)+2H2O(g) △H=-621.5 kJ●mol-1
②N2O4(l)-=N2(g)+2O2(g) △H2=+204.3 kJ●mol-1
則火箭燃料的燃燒反應為2N2H4(l)+N2O4(l)=3N2(g)+4H2O(g) △H=_____.
(2)已知反應N2H4(g)+ 2Cl2(g)![]() N2(g)+4HCl(g),T°C時,向V L恒容密閉容器中加入2 mol N2H4(g)和4 mol Cl2(g) ,測得Cl2和HCl的濃度隨時間的關系如圖所示。
N2(g)+4HCl(g),T°C時,向V L恒容密閉容器中加入2 mol N2H4(g)和4 mol Cl2(g) ,測得Cl2和HCl的濃度隨時間的關系如圖所示。
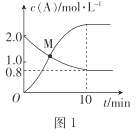
①0~ 10 min內,用N2(g)表示的平均反應速率v(N2)=_______。
②M點時,N2H4的轉化率為______(精確到0.1)%。
③T °C時,達到平衡后再向該容器中加入1.2 mol N2H4(g)、0.4 mol Cl2(g)、0. 8 mol N2 (g)、1.2 mol HCl(g) ,此時平衡______(填“正向移動”“逆向移動”或“不移動”)。
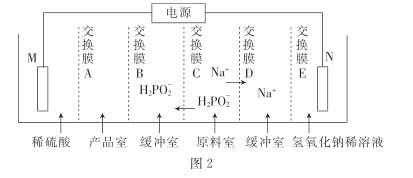
(3)①在惰性氣體中,將黃磷(P4)與石灰乳和碳酸鈉溶液一同加入高速乳化反應器中制得NaH2PO2,同時還產生磷化氫(PH3)氣體,該反應的化學方程式為________________。
②次磷酸(H3PO2)是一元酸,常溫下.1.0 mol●L-1的NaH2PO2溶液pH為8,則次磷酸的Ka=___________。
③用次磷酸鈉通過電滲析法制備次磷酸.裝置如圖2所示。交換膜A屬于____(填“陽離子”或“陰離子”)交換膜,電極N的電極反應式為______,當電路中流過3.8528×105庫侖電量時.制得次磷酸的物質的量為_____ (一個電子的電量為 1.6×10- 19庫侖,NA數值約為6. 02× 1023)。
查看答案和解析>>
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com