
【題目】如圖所示:若關閉Ⅰ閥,打開Ⅱ閥,讓潮濕的氯氣經過甲瓶后,通入乙瓶,布條不褪色;若關閉Ⅱ閥打開Ⅰ閥,再通入這種氣體,布條褪色。甲瓶中所盛的試劑不可能是

A. 濃H2SO4B. NaOH溶液C. NaCl溶液D. Ca(OH)2溶液
科目:高中化學 來源: 題型:
【題目】乙酸橙花酯是一種食用香料,其結構簡式如圖所示,關于該有機物的下列敘述中正確的是
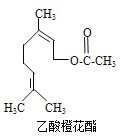
①分子式為C12H20O2
②能使酸性KMnO4溶液褪色
③能發生加成反應,但不能發生取代反應
④它的同分異構體中可能有芳香族化合物,且屬于芳香族化合物的同分異構體有8種
⑤1mol該有機物水解時只能消耗1molNaOH
⑥1mol該有機物在一定條件下和H2反應,共消耗H2為3mol
A. ①②③ B. ①②⑤ C. ①②⑤⑥ D. ①②④⑤⑥
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】釩(23V)被稱為“現代工業味精”,可添加在鋼鐵中,并以鈦-鋁-釩合金的形式用于航天領域;釩的化合物被廣泛用作催化劑、燃料及電池等。我國釩鈦磁鐵礦儲量較大,是世界上產釩大國。請完成下列問題:
(1)釩的基態原子的外圍電子排布式為_____。
(2)釩的某種氧化物的晶胞結構如下圖1所示,則該氧化物的化學式為________,其熔沸點比下圖3(為鄰苯二甲酸酐的結構)物質的熔沸點要________(填“高”、“低”或“差不多”)。
(3)V2O5是一種常見的催化劑,在合成硫酸、硝酸、鄰苯二甲酸酐、乙烯、丙烯中,均使用五氧化二釩作催化劑。

①五氧化二釩的結構簡式如上圖2所示,則該結構中含有_______個π鍵。
②在丙烯(CH3CH=CH2)分子中碳原子的雜化方式分別為__________。
③H、C、N、O四元素,其電負性從大到小的順序依次為___________________。
④V2O5溶解在NaOH溶液中,可得到釩酸鈉(Na3VO4)。列舉與![]() 空間構型相同的一種陽離子:________(填離子符號)。
空間構型相同的一種陽離子:________(填離子符號)。
(4)已知單質釩的晶胞如上圖5所示,假設晶胞的邊長為d×10—7cm,釩的相對原子質量為M,則密度為__________g·cm-3。(設阿伏加德羅常數為NA)
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】在300mL的密閉容器中,放入鎳粉并充入一定量的CO氣體,一定條件下發生反應:Ni(s)+4CO(g)Ni(CO)4(g),已知該反應平衡常數與溫度的關系如表:
溫度/℃ | 25 | 80 | 230 |
平衡常數 | 5×104 | 2 | 1.9×10﹣5 |
下列說法不正確的是
A. 上述生成Ni(CO)4(g)的反應為放熱反應
B. 25℃時反應Ni(CO)4(g)Ni(s)+4CO(g)的平衡常數為2×10﹣5
C. 80℃達到平衡時,測得n(CO)=0.3mol,則Ni(CO)4的平衡濃度為2 mol/L
D. 在80℃時,測得某時刻,Ni(CO)4、CO濃度均為0.5mol/L,則此時v(正)>v(逆)
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】為了除去KNO3固體中含有的少量CaSO4、MgSO4,限選用三種試劑,按下列步驟操作:

(1)寫出下列兩種試劑的化學式:A____,C____。
(2)根據題意,回答下列問題:
①加入過量A的主要目的是____,
②加熱煮沸的目的是___。
(3)操作Ⅰ是____,操作Ⅱ主要是____。
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】在一定條件下,向2L密閉容器中加入2molX、1molY。發生如下反應:2X(g)+Y(?) ![]() 3Z(g) H<0。經60s達平衡,此時Y的物質的量為0.2mol。下列說法正確的是
3Z(g) H<0。經60s達平衡,此時Y的物質的量為0.2mol。下列說法正確的是
A. 反應開始至平衡時,用X表示的化學反應速率為1.2 mol/(L·min)
B. 該反應平衡常數表達式一定是K=c3(Z)/[c2(X)c(Y)]
C. 若再充入1 mol Z,重新達平衡時X的體積分數一定增大
D. 若使容器體積變為1 L,Z的物質的量濃度一定增大
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】一定條件下,通過下列反應可以制備特種陶瓷的原料MgO, MgSO3(s) + CO(g)![]() MgO(s) + CO2(g) +SO2(g) △H>0。該反應在恒容的密閉容器中達到平衡后,若僅改變圖中橫坐標x的值,重新達到平衡后,縱坐標y隨x變化趨勢合理的是
MgO(s) + CO2(g) +SO2(g) △H>0。該反應在恒容的密閉容器中達到平衡后,若僅改變圖中橫坐標x的值,重新達到平衡后,縱坐標y隨x變化趨勢合理的是

選項 | x | y |
A | 溫度 | 容器內混合氣體的密度 |
B | CO的物質的量 | CO2與CO的物質的量之比 |
C | SO2的濃度 | 平衡常數K |
D | MgSO4的質量(忽略體積) | CO的轉化率 |
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】中和滴定是化學定量實驗之一。某學生欲用已知物質的量濃度的鹽酸來測定未知物質的量濃度的氫氧化鈉溶液,請填寫下列空白:
(1)在中和滴定的過程中有如下操作:①用標準溶液潤洗滴定管 ②往滴定管內注入標準溶液 ③檢查滴定管是否漏水 ④滴定,則在操作過程中正確的順序是__________________。(寫序號)
(2)排去堿式滴定管中氣泡的方法應采用如圖所示操作中的________,然后輕輕擠壓玻璃球使尖嘴部分充滿堿液。

(3)選用的指示劑是_____________________ 。(a、石蕊 b、酚酞)
(4)用標準的鹽酸溶液滴定待測的氫氧化鈉溶液時,左手把握酸式滴定管的活塞,右手搖動錐形瓶,眼睛注視______________________。
(5)下列操作中可能使所測氫氧化鈉溶液的濃度數值偏低的是_______________。
A.酸式滴定管未用標準鹽酸溶液潤洗就直接注入標準鹽酸溶液
B.滴定前盛放氫氧化鈉溶液的錐形瓶用蒸餾水洗凈后沒有干燥
C.酸式滴定管在滴定前有氣泡,滴定后氣泡消失
D.讀取鹽酸體積時,開始仰視讀數,滴定結束時俯視讀數
(6)請根據下表中數據計算該氫氧化鈉溶液的物質的量濃度:c(NaOH)= ________________。(精確到小數點后四位)
滴定次數 | 待測氫氧化鈉溶液的體積/ mL | 0.1000 mol/L 鹽酸的體積/ mL | ||
滴定前刻度 | 滴定后刻度 | 溶液體積/ mL | ||
第一次 | 25.00 | 0.00 | 26.10 | 26.10 |
第二次 | 25.00 | 2.00 | 28.08 | 26.08 |
第三次 | 25.00 | 0.22 | 26.34 | 26.12 |
(7)滴定終點的判定依據是_____________________________________________。
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】現有下列8種有機物:①乙炔②甲苯③溴乙烷④乙醇⑤苯酚⑥乙醛⑦乙酸⑧乙酸乙酯。請回答:
(1)實驗室制備①的反應方程式___________________________
(2)能與碳酸氫鈉溶液反應產生氣體的是______________(填序號,下同)
(3)在一定條件下能與濃硝酸反應生成TNT的是________此反應的化學方程式為_____________________________________
(4)能與銀氨溶液發生銀鏡反應的是______此反應的化學方程式為_________________________________________
(5)在一定條件下能與氫氧化鈉水溶液反應的是___________
查看答案和解析>>
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com