
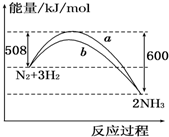
| A. | 該反應的熱化學方程式為:N2+3H2?2NH3△H=-92 kJ/mol | |
| B. | a曲線是加入催化劑時的能量變化曲線 | |
| C. | 加入催化劑,該化學反應的反應熱改變 | |
| D. | 在溫度、體積一定的條件下,通入1 mol N2和3 mol H2反應后放出的熱量為Q1 kJ,若通入2 mol N2和6 mol H2反應后放出的熱量為Q2 kJ,則184>Q2>2Q1 |
分析 A、依據熱化學方程式的書寫原則,標注物質的聚集狀態和反應的熱效應,結合斷鍵吸收熱量,形成化學鍵放出熱量計算反應的焓變,△H=放出的能量-吸收的能量分析;
B、根據催化劑是降低反應的活化能,加快反應速率,不改變平衡分析;
C、根據催化劑不改變化學平衡,催化劑與能耗的關系分析
D、根據可逆反應的特征:反應物不可能充分進行徹底來回答;
解答 解:A、熱化學方程式必須標注物質的聚集狀態反應的焓變,該反應的熱化學方程式為:N2(g)+3H2(g)?2NH3(g),△H=-92kJ•mol-1,故A錯誤;
B、催化劑能改變反應的路徑,使發生反應所需的活化能降低,但不改變化學平衡,反應的熱效應不變,故圖象中的b曲線是加入正催化劑時的能量變化曲線,故B錯誤;
C、催化劑能改變反應的路徑,使發生反應所需的活化能降低,但不改變化學平衡,反應的熱效應不變,故C錯誤;
D、向密閉容器中通入1mol N2和3mol H2,不可能完全轉化,所以達到平衡時放出熱量Q1kJ<92kJ;另一容積相同的密閉容器中通入2mol N2和6mol H2,達到平衡時放出熱量理論上講應該是2×92kJ=184KJ,但反應物不可能充分進行徹底,所以Q2<184KJ,同時通入2mol N2和6mol H2的壓強比通入1mol N2和3mol H2的大了,平衡還會向正向移動,放出的熱量還會增大,即Q2>2Q1,故D正確.
故選D.
點評 本題考查了化學反應中能量轉化與催化劑的關系,熱化學方程式的書寫,圖象的應用能力,難度不大,注意化學平衡的特征是可逆反應.


 尖子生新課堂課時作業系列答案
尖子生新課堂課時作業系列答案 英才計劃同步課時高效訓練系列答案
英才計劃同步課時高效訓練系列答案科目:高中化學 來源: 題型:選擇題
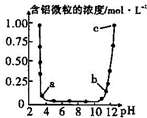 維持溫度不變,向一定物質的量濃度的某AlCl3溶液中加入NaOH固體,忽略溶液體積的變化,溶液的pH與溶液中含鋁微粒的物質的量濃度的關系如圖.以下說法中正確的是( )
維持溫度不變,向一定物質的量濃度的某AlCl3溶液中加入NaOH固體,忽略溶液體積的變化,溶液的pH與溶液中含鋁微粒的物質的量濃度的關系如圖.以下說法中正確的是( )| A. | a點表示溶液中的Al3+開始轉化為Al(OH)3沉淀 | |
| B. | 據圖可知,配制一定物質的量濃度的AlCl3溶液時,需要加入適量的H2SO4溶液抑制水解 | |
| C. | 當溶液的pH在6至8之間,鋁元素全部以Al(OH)3的形式存在 | |
| D. | b點所對應的溶液中主要含鋁微粒的水解程度大于c點 |
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
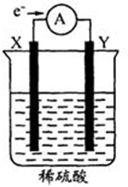 如圖,在盛有稀H2SO4的燒杯中放入用導線連接的電極X、Y,外電路中電子流向如圖所示.下列關于該裝置的判斷正確的是( )
如圖,在盛有稀H2SO4的燒杯中放入用導線連接的電極X、Y,外電路中電子流向如圖所示.下列關于該裝置的判斷正確的是( )| A. | 外電路的電流方向為:X→導線→Y | |
| B. | 若兩電極都是金屬,則它們的活動性順序為X>Y | |
| C. | X極上發生的是還原反應,Y極上發生的是氧化反應 | |
| D. | 溶液中的SO42-向Y極移動 |
查看答案和解析>>
科目:高中化學 來源: 題型:多選題
| A. | 含氧酸的酸性:H3ZO4>H2YO4>HXO4 | |
| B. | 非金屬性:X>Y>Z | |
| C. | 氣態氫化物的穩定性按X、Y、Z順序由弱到強 | |
| D. | 元素的負化合價的絕對值按X、Y、Z順序由小到大 |
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| A. | 原子半徑 A>B>D>C | B. | 原子序數 d>c>b>a | ||
| C. | 離子半徑 C3->D->B+>A2+ | D. | 單質的還原性 A>B>D>C |
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| A. | 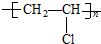 | B. | 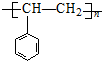 | ||
| C. | 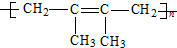 | D. | 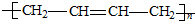 |
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| 實驗序號 | (1) | (2) | (3) |
| 取用鹽酸的體積/mL | 25 | 25 | 25 |
| 取用混合物的質量/g | 1.32 | 1.54 | 2.20 |
| 生成氣體的體積(標準狀況)/mL | 336 | 392 | 448 |
| A. | 1.2 | B. | 1.4 | C. | 1.6 | D. | 無法計算 |
查看答案和解析>>
科目:高中化學 來源: 題型:填空題
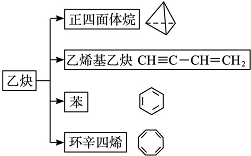
 .
.查看答案和解析>>
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com