
| A. | 非自發的氧化還原反應不可以設計成原電池 | |
| B. | 將反應 3Cu+8HNO3═3Cu(NO3)2+2NO+4H2O 設計成原電池,其正極反應為:2NO3-+6e-+8H+═2NO+4H2O | |
| C. | 鉛蓄電池工作時,正極、負極質量均增加 | |
| D. | 氫氧燃料電池耗H20.1mol時,電路中流經的電子數為0.1NA |
分析 A.原電池反應為自發的氧化還原反應;
B.原電池中得電子的為正極;
C.鉛蓄電池工作時Pb、PbO都生成硫酸鉛;
D.氫氧燃料電池耗H20.1mol時,電路中流經的電子數為0.2NA.
解答 解:A.原電池反應為自發的氧化還原反應,所以非自發的氧化還原反應不可以設計成原電池,故A正確;
B.原電池中得電子的為正極,所以將反應 3Cu+8HNO3═3Cu(NO3)2+2NO+4H2O 設計成原電池,其正極反應為:2NO3-+6e-+8H+═2NO+4H2O,故B正確;
C.放電時,鉛失電子發生氧化反應而作負極,電極反應式為Pb-2e-+SO42-=PbSO4,二氧化鉛得電子作正極,電極反應式為PbO2+SO42-+2e-+4H+═PbSO4+2H2O,兩極均生成難溶性的PbSO4,所以兩極質量均增加,故C正確;
D.氫氧燃料電池中負極反應為H2-2e-=2H+,所以消耗H2 0.1mol時,電路中流經的電子數為0.2NA,故D錯誤;
故選D.
點評 本題考查了原電池原理、電極方程式的書寫、轉移電子的計算,題目難度不大,明確原電池中正負極的判斷以及電極方程式的書寫方法是解題的關鍵.


 舉一反三期末百分沖刺卷系列答案
舉一反三期末百分沖刺卷系列答案科目:高中化學 來源: 題型:選擇題
| A. | 常溫常壓下,8g CH4含有5NA個電子 | |
| B. | 標準狀況下,22.4L氦氣含有2NA個原子 | |
| C. | 常溫常壓下,22.4L CO2和SO2混合氣體含有2NA個氧原子 | |
| D. | 46gNO2和N2O4的混合氣體含氮原子數可能為1.5NA個 |
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| A. | 電池的電解質溶液為堿性溶液,陽離子向正極移動 | |
| B. | 電池放電時,負極反應為Fe+2OH--2e-=Fe(OH)2 | |
| C. | 電池充電過程中,陰極附近溶液的pH降低 | |
| D. | 電池充電時,陽極反應為2Ni(OH)2+2OH--2e-═Ni2O3+3H2O |
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| A. | 物質所含元素化合價升高的反應是氧化反應 | |
| B. | 物質所含元素化合價降低的反應是還原反應 | |
| C. | 氧化劑本身被還原,具有氧化性;還原劑本身被氧化,具有還原性 | |
| D. | 氧化反應和還原反應不一定同時存在于一個反應中 |
查看答案和解析>>
科目:高中化學 來源: 題型:解答題

查看答案和解析>>
科目:高中化學 來源: 題型:解答題
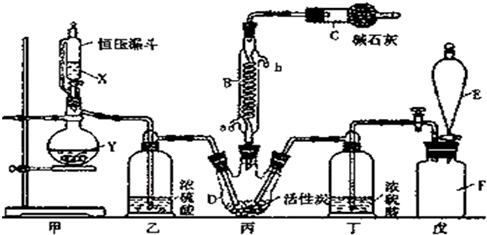
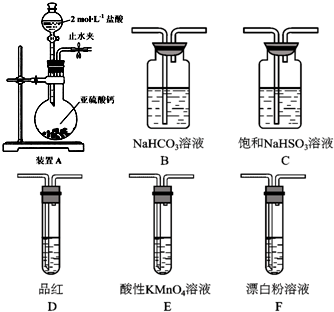
查看答案和解析>>
科目:高中化學 來源: 題型:解答題
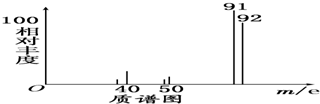
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| A. | (a+0.5b-1.5c) kJ•mol-1 | B. | (a-0.5b+1.5c) kJ•mol-1 | ||
| C. | (2a+b-3c) kJ•mol-1 | D. | (2a+b+3c) kJ•mol-1 |
查看答案和解析>>
科目:高中化學 來源: 題型:解答題
查看答案和解析>>
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com