
【題目】根據物質結構的有關性質和特點,回答下列問題:
(1)基態氮原子的外圍電子排布圖為_____________,基態鎂原子核外電子有__________種空間運動狀態。
(2)丙烯腈(CH2=CH-CN)分子中碳原子軌道雜化類型是____________,H、C、N元素的電負性由大到小的順序為___________。
(3)配合物[Cu(CH3CN)4]BF4[四氟硼酸四(乙腈)合銅(I)]是有機合成中常見催化劑。該配合物中陰離子的空間構型為___________,與其互為等電子體的分子或離子是____________(各舉1例)。
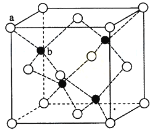
(4)ZnS在熒光體、光導體材料、涂料、顏料等行業中應用廣泛。立方ZnS晶體結構如下圖所示,其晶胞邊長為540.0pm,密度為__________g/cm3(列出計算式即可),a位置S2-離子與b位置Zn2+離子之間的距離為__________pm。
【答案】![]() 12 sp2、sp N>C>H 正四面體 分子: CCl4、SiF4、SiCl4等 離子:PO43- SO42- ClO4-等
12 sp2、sp N>C>H 正四面體 分子: CCl4、SiF4、SiCl4等 離子:PO43- SO42- ClO4-等 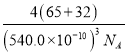 135
135![]()
【解析】
(1)N是7號元素,根據構造原理書寫其核外電子排布,進而得到其外圍電子排布圖;原子核外有多少電子,電子的運動狀態就有多少;
(2)根據丙烯腈分子中C原子形成的共價鍵特點分析C原子雜化方式;元素的非金屬性越強,其電負性越大;
(3)判斷空間構型時可利用價層電子對互斥理論。BF4-中無孤電子對,有4個σ鍵電子對,故呈四面體形;尋找等電子體時可利用價電子遷移法找到。
(4)利用均攤法計算晶胞中含有的硫原子和鋅原子,根據ρ=![]() 計算密度;每個黑色小球連接4個白色小球,構成正四面體結構,白球和黑球之間的夾角為109°28′,兩個白球之間的距離為晶胞體對角線的
計算密度;每個黑色小球連接4個白色小球,構成正四面體結構,白球和黑球之間的夾角為109°28′,兩個白球之間的距離為晶胞體對角線的![]() 。
。
(1) N是7號元素,根據構造原理,可得其核外電子排布1s22s22p3,價電子排布式為2s22p3,價電子排布圖為![]() ;
;
由于在任何原子中都不存在運動狀態完全相同的電子,所以Mg是12號元素,原子核外有12個電子,電子的運動狀態就有12種;
(2)丙烯腈分子結構簡式是CH2=CH-C≡N,可見碳碳雙鍵的C原子是sp2雜化,-C≡N中C原子是三鍵,C原子是sp雜化;在該物質的分子中含有H、C、N三種非金屬性元素,元素的非金屬性N>C>H,所以元素的電負性N>C>H;
(3)配合物[Cu(CH3CN)4]BF4[四氟硼酸四(乙腈)合銅(I)]是有機合成中常見催化劑。該配合物中陰離子為BF4-,中心原子B的價層電子對數為4+![]() =4,空間構型為正四面體形;根據等電子體概念可知與其互為等電子體的分子是CCl4、SiF4、SiCl4等 離子:PO43-、SO42- 、ClO4-等。
=4,空間構型為正四面體形;根據等電子體概念可知與其互為等電子體的分子是CCl4、SiF4、SiCl4等 離子:PO43-、SO42- 、ClO4-等。
(4)S2-離子個數:![]() ×8+
×8+![]() ×6=4;含有Zn2+的個數為1×4=4,因此一個晶胞中含4個ZnS,由于晶胞參數為540.0pm,所以晶胞的密度ρ=
×6=4;含有Zn2+的個數為1×4=4,因此一個晶胞中含4個ZnS,由于晶胞參數為540.0pm,所以晶胞的密度ρ=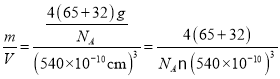 g/cm3;
g/cm3;
每個黑色小球連接4個白色小球,構成正四面體結構,二者的距離為晶胞參數對角線的![]() ,則其距離為L=
,則其距離為L=![]() ×
×![]() 540.0pm=135
540.0pm=135![]() pm。
pm。


科目:高中化學 來源: 題型:
【題目】實驗室可通過蒸餾石油得到多種沸點范圍不同的餾分,裝置如圖所示。下列說法不正確的是
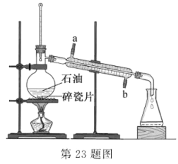
A.沸點較低的汽油比沸點較高的柴油先餾出
B.蒸餾燒瓶中放人沸石可防止蒸餾時發生暴沸
C.冷凝管中的冷凝水應該從 a 口進 b 口出
D.溫度計水銀球的上限和蒸餾燒瓶支管口下沿相平
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】下列實驗的反應原理用離子方程式表示正確的是( )
A. 用濃鹽酸酸化的KMnO4溶液與H2O2反應,證明H2O2具有還原性:2MnO4-+6H++5H2O2![]() 2Mn2++5O2↑+8H2O
2Mn2++5O2↑+8H2O
B. 用氫氧化鈉溶液除去鎂粉中的雜質鋁:2Al+2OH-![]() 2AlO2-+H2↑
2AlO2-+H2↑
C. 室溫下測得氯化銨溶液pH<7,證明一水合氨是弱堿:NH4++2H2O![]() NH3·H2O+H3O+
NH3·H2O+H3O+
D. 用酸性高錳酸鉀標準溶液滴定草酸:2MnO4-+16H++5C2O42-![]() 2Mn2++10CO2↑+8H2O
2Mn2++10CO2↑+8H2O
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】已知有以下物質相互轉化:
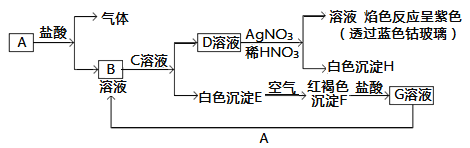
試回答:
(1)寫出B的化學式________,D的化學式________。
(2)寫出由E轉變成F的化學方程式________________________。
(3)寫出用KSCN鑒別G溶液的離子方程式________________;向G溶液加入A的有關離子反應方程式________________。
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】由SO2和O2制備SO3(熔點16.8 ℃,沸點44.8 ℃)的模擬裝置如圖所示(加熱和夾持裝置省略):
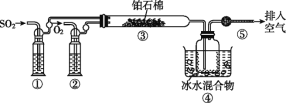
下列說法正確的是( )
A.裝置①中的試劑為飽和NaHSO3溶液
B.實驗室可用銅與濃硫酸在常溫條件下制取SO2
C.裝置③反應管中的鉑石棉用作反應的催化劑
D.從裝置⑤逸出的氣體有過量的SO2和O2
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】疊氮化鈉(NaN3)是一種易溶于水的白色晶體,微溶于乙醇,不溶于乙醚,可用于合成抗生素頭孢菌素藥物的中間體、汽車安全氣囊的藥劑等。氨基鈉(NaNH2)的熔點為210℃,沸點為400℃,在水溶液中易水解。實驗室制取疊氮化鈉的實驗步驟及實驗裝置如下:
①打開止水夾K1,關閉止水夾K2,加熱裝置D一段時間;
②加熱裝置A中的金屬鈉,使其熔化并充分反應后,再停止加熱裝置D并關閉K1;
③向裝置A中b容器內加入加熱介質并加熱到210~220℃,打開止水夾K2,通入N2O;
④冷卻,向產物中加入乙醇,減壓濃縮結晶后,再過濾,并用乙醚洗滌,晾干。
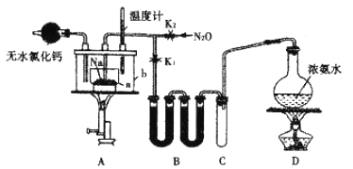
回答下列問題:
(1)裝置B中盛放的藥品為____________。
(2)氨氣與熔化的鈉反應生成NaNH2的化學方程式為__________。
(3)步驟③中,為了使反應受熱均勻,A裝置里a容器的加熱方式為__________;生成NaN3的化學方程式為__________;N2O可由NH4NO3在240~245℃分解制得(硝酸銨的熔點為169.6℃),則應選擇的氣體發生裝置是_____________(填序號)。

(4)步驟④中用乙醚洗滌的主要目的是______________。
(5)實驗室用滴定法測定疊氮化鈉樣品中NaN3的質量分數:
①將2.500g試樣配成500.00mL溶液。
②取50.00mL溶液置于錐形瓶中,加入50.00mL0.1010mol/L(NH4)2Ce(NO3)6溶液。
③充分反應后,將溶液稍稀釋,向溶液中加入8mL濃硫酸,滴入3滴鄰菲啰啉指示液,用0.0500mol/L(NH4)2Fe(SO4)2標準溶液滴定過量的Ce4+消耗溶液體積為29.00mL。測定過程的反應方程式為:2(NH4)2Ce(NO3)6+2NaN3=4NH4NO3+2Ce(NO3)3+2NaNO3+3N2↑;Ce4++Fe2+=Ce3++Fe3+,則試樣中NaN3的質量分數為_______________。
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】中國海軍航母建設正在有計劃、有步驟向前推進。建造航母需要大量的新型材料。航母的龍骨要耐沖擊,航母的甲板要耐高溫,航母的外殼要耐腐蝕。
(1)鎳鉻鋼抗腐蝕性能強,Ni2+基態原子的核外電子排布為_______________________.
(2)航母甲板涂有一層耐高溫的材料聚硅氧烷結構如圖所示,其中C原子雜化方式為______雜化,在有機物中C原子間可以形成雙鍵,而硅烷中Si原子間難以形成雙鍵的原因是_____________.
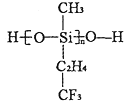
(3)海洋是元素的搖籃,海水中含有大量鹵族元素。
①根據下表數據判斷:最有可能生成較穩定的單核陽離子的鹵素原子是_________(填元素符號)
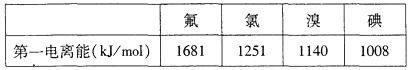
②根據價層電子對互斥理論,預測ClO的空間構型為___________形,寫出一個ClO的等電子體的化學符號___________.
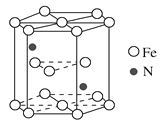
(4)海底金屬軟泥是在洋海底蘊藏著大量的資源,含有硅、鐵、錳、鋅等。某種磁性氮化鐵的晶胞結構如圖所示,該化合物的化學式為________________,若晶胞底邊長為a nm,高為c nm,則這種磁性氮化鐵的晶體密度為________g·cm3(用含a、c和NA的式子表示)
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】銅及其化合物在工業生產中應用廣泛。
Ⅰ.某同學設計如下實驗裝置測定銅的相對原子質量(夾持和加熱儀器已略去),并檢驗氯氣的氧化性。
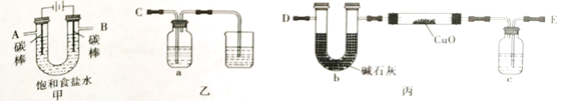
(1)該實驗裝置的連接順序為:A連接________,B連接________(填字母)。
(2)乙裝置a瓶中的溶液可以是_______
A.NaOH溶液 B.Na2S溶液 C.酸性KMnO4溶液 D.含少量KSCN的FeCl2溶液
(3)對丙裝置進行加熱前需要________ 。
(4)準確稱量 m g CuO進行實驗,當CuO完全反應后測出b中增重n g。則Cu的相對原子質量為________ (只要求列出算式)。該實驗方案的裝置有不合理之處,若不加以改正會導致測定結果________(填“偏大”、”偏小“或”不變“)。
Ⅱ.研究發現Cu與稀鹽酸不反應,但在持續通入空氣的條件下可反應生成CuCl2。
(5)已知Fe3+對該反應有催化作用,其催化原理如圖所示:
![]()
則圖中的M‘為________(填化學符號)
(6)向CuCl2溶液中通入H2S氣體,可產生CuS沉淀,反應離子方程式為:Cu2++H2S=CuS(s)+2H+ , 則該反應的平衡常數K=________(保留一位小數)。已知:CuS溶度積KSP=1.0×10-36 , H2S電離常數Ka1=1.3×10-7 , Ka2=7.0×10-15。
查看答案和解析>>
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com