
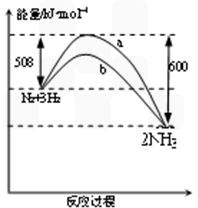
 2NH3(g) ΔH = 92kJ·mol-1
2NH3(g) ΔH = 92kJ·mol-1 科目:高中化學 來源: 題型:閱讀理解
| Cu2O |
| 時間/min | 20 | 40 | 60 | 80 |
| n(O2)/mol | 0.0010 | 0.0016 | 0.0020 | 0.0020 |

查看答案和解析>>
科目:高中化學 來源:2012-2013學年河南省商丘市高三第三次模擬考試理綜化學試卷(解析版) 題型:推斷題
短周期元素A、B、C、D、E原子序數依次增大。A是周期表中原子半徑最小的元素,B原子的價電子數等于該元素最低化合價的絕對值,C與D能形成D2C和D2C2兩種化合物,而D是同周期中金屬性最強的元素,E的負一價離子與C和A形成的某種化合物分子含有相同的電子數。
(1)A、C、D形成的化合物中含有的化學鍵類型為 。
(2)已知:①E-E→2E·;△H=+a kJ·mol-1
② 2A·→A-A;△H=-b kJ·mol-1
③E·+A·→A-E;△H=-c kJ·mol-1(“·”表示形成共價鍵所提供的電子)
寫出298K時,A2與E2反應的熱化學方程式 。
(3)在某溫度下、容積均為2L的三個密閉容器中,按不同方式投入反應物,保持恒溫恒容,使之發生反應:2A2(g)+BC(g) X(g);△H=-dJ·mol-1(d>0,X為A、B、C三種元素組成的一種化合物)。初始投料與各容器達到平衡時的有關數據如下:
X(g);△H=-dJ·mol-1(d>0,X為A、B、C三種元素組成的一種化合物)。初始投料與各容器達到平衡時的有關數據如下:
|
實驗 |
甲 |
乙 |
丙 |
|
初始投料 |
2 molA2、1 molBC |
1 molX |
4 molA2、2 molBC |
|
平衡時n(X) |
0.5mol |
n2 |
n3 |
|
反應的能量變化 |
放出Q1kJ |
吸收Q2kJ |
放出Q3kJ |
|
體系的壓強 |
P1 |
P2 |
P3 |
|
反應物的轉化率 |
α1 |
α2 |
α3 |
①在該溫度下,假設甲容器從反應開始到平衡所需時間為4 min,則該時間段內A2的平均反應速率v(A2) 。
②該溫度下此反應的平衡常數K的值為 。
③三個容器中的反應分別達平衡時各組數據關系正確的是 (填序號)。
A.α1+α2=1 B.Q1+Q2=d C.α3<α1
D.P3<2P1=2P2 E.n2<n3<1.0mol F.Q3=2Q1
④在其他條件不變的情況下,將甲容器的體系體積壓縮到1L,若在第8min達到新的平衡時A2的總轉化率為65.5%,請在下圖中畫出第5min 到新平衡時X的物質的量濃度的變化曲線。

查看答案和解析>>
科目:高中化學 來源:2010-2011學年江西省高三下學期第一次模擬考試(理綜)化學部分 題型:化學題
對于一個化學反應的研究需要從反應條件、限度、速率、定量關系等因素進行綜合分析,下列是關于化學反應的系列研究,請根據相關信息回答問題。
⑴關于反應物之間的定量關系的研究:
已知反應:Br2 +2Fe2+=2 Br -+2Fe3+,向10 mL0 .1mol/L的Fe Br2溶液中通入0 .003mol Cl2,該反應的離子方程式為
⑵關于反應速率、限度的研究:
①已知298K時,Mg(OH)2的溶度積常數Ksp=5.6×10-12,在氯化鎂溶液中加入一定量的燒堿,測得pH=13.0,則此溫度下殘留在溶液中的c(Mg 2+)=
②科學研究發現納米級的Cu2O可作為太陽光分解水的催化劑。
一定溫度下,在2L密閉容器中加入納米級的Cu2O并通入0 .1mol水蒸氣,發生反應:
 2 H2O(g)
2 H2O(g)
2 H2 (g) + O2(g) △H=+484kJ· mol-1,不同時段產生O2的量見下表:
|
時間/min |
20 |
40 |
60 |
80 |
|
n(O2)/mol |
0.0010 |
0.0016 |
0.0020 |
0.0020 |
則前20min的反應速率v(H2O)= ;達到平衡時,至少需要吸收的光能為 kJ。
③向某密閉容器中加入0 .3molA、0 .1molC和一定量的B三種氣體。一定條件下發生反應,各物質濃度隨時間變化如下圖中甲圖所示。附圖中乙圖為t2時刻后改變容器中條件,平衡體系中反應速率隨時間變化的情況,且四個階段都只改變一種條件。已知t3~t4為使用催化劑,甲圖中t0~t1階段c (B)未畫出。請回答:

Ⅰ:t4~t5階段改變的條件是 t5~t6階段改變的條件是
Ⅱ:B的起始濃度為 ,該反應方程式為
查看答案和解析>>
科目:高中化學 來源: 題型:閱讀理解
(10分)氨氣在農業和國防工業都有很重要的作用,歷史上諾貝爾化學獎曾經有3次頒給研究氮氣與氫氣合成氨的化學家。
⑴下圖表示了298K時氮氣與氫氣合成氨反應過程中的能量變化,據此請回答:

對于合成氨的反應下列說法正確的是 (填編號)。
A.該反應在任意條件下都可以自發進行
B.加入催化劑,能使該反應的E和△H都減小
C.若該反應在298K、398K時的化學平衡常數分別為K1、K2,則K1>K2
D.該反應屬于人工固氮
⑵現在普遍應用的工業合成氨的方法為N2+3H2![]() 2NH3,是哈伯于1905年發明的,但此法達到平衡時反應物的轉化率不高。
2NH3,是哈伯于1905年發明的,但此法達到平衡時反應物的轉化率不高。
①能使該反應的反應速率增大,且平衡向正反應方向移動的措施是 。
A.使用的更高效催化劑 B.升高溫度
C.及時分離出氨氣 D.充入氮氣,增大氮氣的濃度(保持容器體積不變)
②若在某溫度下,2L的密閉容器中發生N2+3H2![]() 2NH3的反應,下圖表示N2的物質的量隨時間的變化曲線。用H2表示0~10min內該反應的平均速率v(H2)= 。
2NH3的反應,下圖表示N2的物質的量隨時間的變化曲線。用H2表示0~10min內該反應的平均速率v(H2)= 。
從11min起,壓縮容器的體積為1L,則n(N2)的變化曲線為 。
A. a B.b C.c D.d


⑶隨著對合成氨研究的發展,2001年兩位希臘化學家提出了電解合成氨的方法,即在常壓下把氫氣和用氦氣稀釋的氮氣,分別通人一個加熱到500℃的電解池中,采用高質子導電性的SCY陶瓷(能傳遞H+)為介質里,用吸附在它內外表面上的金屬鈀多晶薄膜作電極,實現了常壓、570℃條件下高轉化率的電解法合成氮(裝置如右上圖)。則鈀電極上的電極反應式是 。
查看答案和解析>>
科目:高中化學 來源: 題型:閱讀理解
氨氣在農業和國防工業都有很重要的作用,歷史上諾貝爾化學獎曾經有3次頒給研究氮氣與氫氣合成氨的化學家。
⑴下圖表示了298K時氮氣與氫氣合成氨反應過程中的能量變化,據此請回答:

對于合成氨的反應下列說法正確的是 (填編號)。
A.該反應在任意條件下都可以自發進行
B.加入催化劑,能使該反應的E和△H都減小
C.若該反應在298K、398K時的化學平衡常數分別為K1、K2,則K1>K2
D.該反應屬于人工固氮
⑵現在普遍應用的工業合成氨的方法為N2+3H2![]() 2NH3,是哈伯于1905年發明的,但此法達到平衡時反應物的轉化率不高。
2NH3,是哈伯于1905年發明的,但此法達到平衡時反應物的轉化率不高。
①能使該反應的反應速率增大,且平衡向正反應方向移動的措施是 。
A.使用的更高效催化劑 B.升高溫度
C.及時分離出氨氣 D.充入氮氣,增大氮氣的濃度(保持容器體積不變)
②若在某溫度下,2L的密閉容器中發生N2+3H2![]() 2NH3的反應,下圖表示N2的物質的量隨時間的變化曲線。用H2表示0~10min內該反應的平均速率v(H2)= 。
2NH3的反應,下圖表示N2的物質的量隨時間的變化曲線。用H2表示0~10min內該反應的平均速率v(H2)= 。
從11min起,壓縮容器的體積為1L,則n(N2)的變化曲線為 。
A. a B.b C.c D.d


⑶隨著對合成氨研究的發展,2001年兩位希臘化學家提出了電解合成氨的方法,即在常壓下把氫氣和用氦氣稀釋的氮氣,分別通人一個加熱到500℃的電解池中,采用高質子導電性的SCY陶瓷(能傳遞H+)為介質里,用吸附在它內外表面上的金屬鈀多晶薄膜作電極,實現了常壓、570℃條件下高轉化率的電解法合成氮(裝置如右上圖)。則鈀電極上的電極反應式是 。
查看答案和解析>>
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com